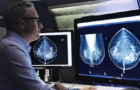
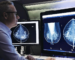
제가 2019년 7월 식약처 첨단의료기기과 전문가 협의체에서 발표한 자료입니다. FDA가 지난 4월에 발표한, 인허가 이후에 계속 변화하는 인공지능을 어떻게 규제할지에 대한 discussion paper 인 “Proposed Regulatory Framework for Modifications to Artificial Intelligence Machine Learning (AI/ML)-Based Software as a Medical Device (SaMD): Discussion Paper and Request for Feedback” (링크)을 정리한 자료입니다.
지금까지 FDA든 식약처이든 인공지능은 인허가 이후에는 변화가 허용되지 않는 locked algorithm을 전제로 인허가 받았는데요. 인공지능의 근본적인 속성인 “Iterative, autonomous, adaptive nature”를 어떻게 최대한 활용하면서, 또 한 편으로는 의료기기로서의 안전성과 유효성은 보장할 수 있을지에 대한 규제기관의 고민이 담겨 있습니다.
- 관련 포스팅: 지속적으로 바뀌는 의료 인공지능을 어떻게 규제할 것인가
Discover more from 최윤섭의 디지털 헬스케어
Subscribe to get the latest posts sent to your email.