제가 최근에 보스턴에서 참석한 DTxDM 컨퍼런스에 대한 후기입니다. 이는 디지털 신약(digital therapeutics)에 관한 컨퍼런스로, 올 봄에 첫번째 행사를 산호세에서 하였고, 이번이 제2회 행사였습니다. 규모는 크지 않았지만 이 분야에서 일하는 전 세계 200-300명 정도의 사람들이 모여서 1박 2일 동안 심도 있는 이야기를 나누는 즐거운 자리였습니다. 참가자들도 스타트업과 투자자에서, 병원, 보험사, 제약사, 규제기관 등 매우 다양하였습니다. 아래는 이번 행사에 참여한 패널들의 의견을 바탕으로 제 의견도 가미되어 있습니다. 디지털 신약에 대한 일반적인 소개는 제 다른 포스팅을 참고하시기 바랍니다.
DTxDM 컨퍼런스
디지털 신약은 말 그대로 앱, 게임, 챗봇, VR 등의 디지털 헬스케어 기법을 환자를 치료하기 위한 ‘약’과 같은 목적으로 활용하고자 하는 분야이다. 디지털 헬스케어 분야 중에서도 환자의 질병을 직접적으로 진단, 치료, 관리, 예방하는 가장 적극적인 분야라고 할 수 있다.
최근에 디지털 신약은 엄청나게 빠른 성장을 거듭하고 있다. 하루가 다르게 새로운 기업이 등장하고 있으며 다국적 제약사에서도 몇 년 사이에 관심이 크게 증가했다. 뿐만 아니라, 인허가를 받거나 임상 연구에서 좋은 결과를 내는 사례들이 증가하고 있다. 새롭게 나오는 이 분야의 기업은 아무래도 스타트업인데, 한 패널 토의에서는 예전에 비해 지나치게(?) 많은 스타트업이 등장하고 있다며 (‘예전에는 한 달에 몇 개의 기업이 나왔는데, 이제는 며칠에 몇 개의 새로운 기업이 나온다’) 우스갯소리를 할 정도였다.
형태가 완전히 다른 새로운 종류의 신약을 개발하는 분야이기 때문에 기존에 신약을 개발하고, 인허가하고, 처방하고, 판매하고, 복용하는 전체 과정에 참여하는 주체들이 관심을 가질 수밖에 없다. 이번 DTxDM에도 노바티스, 사노피, 존슨앤존슨, 아스트라제네카와 같은 다국적 제약사의 임원들뿐만 아니라, 임상연구자, 보험사, 투자자, 인허가 관계자 등이 참석하여 그 높은 관심을 증명했다. 이런 모습은 또 한 편으로, 이 분야가 (기존의 신약개발과 같이) 아주 많은 이해관계가 얽혀 있기 때문에 결코 녹록하지 않은 분야라는 점을 보여주는 것이기도 하다.
특히, 디지털 신약을 둘러싼 연구, 투자, 규제, 수가 등이 현재 과도기적인 단계를 거치고 있으면서, 하루가 다르게 격변하고 있다. 5년 뒤에 이 분야가 어디까지 발전해 있을지 예측하기가 어렵다는 의견들이 패널 토의에서 나오기도 했다. 향후 미래가 기대되는 분야이자, 또 결코 쉽지 않은 분야가 될 것이다.
누구도 가보지 않은 길
디지털 신약에 대해서는 많은 의견이 있다. 필자는 이번에 알킬리(Akili)의 CEO인 Eddie Martucci가 패널 토의 중에 했던 이야기가 인상 깊었다. 알킬리는 태블릿 PC 형태의 아동의 ADHD 치료용 게임을 개발하는 회사이다. 작년 말에 대규모 임상 3상에서 유의미한 효과를 보였고, 현재 FDA의 결정을 기다리고 있다. Eddie는 패널 토의에서 “우리는 약효를 가지는 ‘게임’이 아니라, 게임이라는 형태를 가지는 ‘약’이다.” 라고 언급했다. 즉, 새로운 형태를 가지고 있지만, 기존의 약과 동일하기 때문에 전통적으로 신약 개발에서 거치는 과정과 어려움을 그대로 겪어야만 할 것이다. 뿐만 아니라, 거기에 더해서 ‘디지털’ 이기 때문에 새롭게 극복해야 하는 숙제들도 있다.
대략 정리해보면 아래와 같이 나누어서 생각해볼 수 있을 것이다.
임상연구 – 인허가 – 보험수가 – 의사의 처방 – RWE 활용 – 환자의 사용
디지털 신약 분야에서 가본 사람이 거의 아무도 없다. 이 과정 하나하나가 산 넘어 산이며, 각 과정을 어떻게 돌파하는 것이 정답인지를 아무도 알지 못한다. 작년에 중독 치료용 목적으로 FDA De Novo 인허가를 받은 Pear Therapeutics 정도가 가장 많이 진행되어 있다고 볼 수 있다. 이는 환자가 의사의 처방을 받아서 사용하는 치료용 앱으로, 이를 제외하면 아직 인허가의 문턱을 넘은 디지털 신약도 거의 없다고 할 수 있다.
제약사는 이 모든 과정을 통과하여 환자에게 사용되는 신약을 수없이 만들어내었지만, 기존의 약과 디지털 신약이 어디까지 어떻게 같으리라는 것 자체를 아직 알지 못한다. 이렇게 미증유의 경험을 하게 되는 것은 개발사뿐만 아니라, FDA와 같은 규제기관을 비롯하여, 보험사, 병원, 의사, 환자 모두 마찬가지다. 이들이 디지털 신약을 과연 어떻게 인식할 것이며, 이 주체들을 어떻게 설득할 것인지는 아직 미지수로 남아 있다. 다만 결코 단기간에 되지는 않을 것이라는 점은 확실하다.
어떻게 증명할 것인가
첫날 패널 토의와 워크샵에서 가장 치열한 토론을 벌였던 주제 중의 하나가 바로 RCT가 필요하냐에 대한 것이었다. 디지털 신약의 경우에도 randomized clinical trial 이 필요할까의 문제이다. 이를 하면 (할 수 있으면) 당연히 좋겠지만, 과연 모든 디지털 신약의 경우에 RCT를 거쳐야만 하는 것인지에 대해서는 이 분야의 실무자들 사이에서도 의견이 갈렸다. 결국은 비용 혹은 기회 비용의 문제이며, 어떠한 문제를 풀기 위한 디지털 신약인지에 따라서 여기에 대한 답이 달라질 수도 있다.
또한 이 디지털 신약의 효능을 어떠한 outcome으로 증명할 것인지도 쉽지 않은 문제이다. 특히 디지털 신약은 사용하면서 환자의 RWD(Real-World Data)를 만들어내게 된다. 이러한 RWD는 질병을 치료 및 관리하는 새로운 방식이나, 의료진의 새로운 역할, 의료진-환자의 새로운 관계를 정립할 수 있기 때문에 단순히 효능(efficacy)만을 볼 것이 아니라, 환자에게 어떠한 ‘가치’를 주는지에 대한 분석이 필요하다. 최근에 미국에서는 소위 가치 기반의 의료 (value based outcome)가 대두되고 있기 때문에, 여기에 대해서는 디지털 신약이 큰 기회를 가질 수도 있다.
어떠한 모델을 택할 것인가: BM, 인허가, 처방 여부
뿐만 아니라, 개발사의 입장에서 어떠한 모델로 사용자에게 디지털 신약을 전달할 것인가도 큰 이슈이다. 예를 들어, 의료기기로서 규제기관의 인허가를 받는 것이 좋은가? 인허가를 받는다면 어떠한 regulatory pathway를 이용할 것인가? 의사의 처방을 받아서 구매하는 prescribed drug이 될 것인가? 혹은 인허가 자체를 받지 않고 B2C로 바로 서비스 할 것인가? 등등.
특히 인허가만 하더라도 현재 가장 많이 진행된 회사들도 각각 다른 방식의 접근을 취하고 있다.
- Pear Therapeutics: 2017년에 De Novo로 FDA 인허가를 받았고, 의사의 처방을 받음; Pre-Cert 파일럿 중
- Akili: 2017년 임상 3상을 끝내고, 현재 FDA 리뷰 중 (아마도 De Novo일 듯)
- Dthera Sciences: 2018년 8월부터 FDA의 Breakthrough Devices Program을 시작
특히 Dthera의 경우에 the Breakthrough Devices Program를 통하면 CPT 코드를 자동으로 발급받을 수 있다며, 이에 대해서 상당히 긍정적으로 이야기했던 것이 기억에 남는다.
사실 규제와 관련해서는 디지털 신약에 대한 FDA의 경험도 많지 않고, 관련 규제가 아직 완전하게 확정된 것은 아니라는 점이 불확실성을 높이기도 한다. FDA가 이에 관한 경험이 많지 않다는 것은 EU, 중국 등 다른 나라의 경우에는 그러한 경험이 더 없다는 것을 의미한다. (사실 FDA는 지난 몇 년 동안 Mobile Medical App, Wellness Deivce 관련 가이드라인을 내어놓으면서 상대적으로는 아주 명확한 규제를 가지고 있다고 볼 수 있다.)
업계에서 화제가 되고 있는 FDA의 Pre-Cert 만 하더라도 확정이 되려면 앞으로 적어도 2-3년이 더 걸릴 예정이다. 이번 컨퍼런스에서 FDA에서 디지털 헬스 유닛을 맞고 있는 Bakul Patel이 원격으로 관련 발표를 하였는데, 올해 말까지 Working Model v1.0 확정, 2019년에 소규모 파일럿 실시, 2020년에 대규모 파일럿으로 확대하려는 계획이다.
이번에 워크샵에서 상당히 재미있는 이야기를 많이 해주었던 Pear Therapeutics의 규제 부문 부사장 David Amor에게는 필자가 개인적으로 Pre-Cert에 대해서 의견을 물어보았더니, (Pear Therapeutics는 작년에 De Novo 인허가, Pre-Cert의 파일럿으로 참여하는 9개 기업 중의 하나로 FDA와 매우 밀접하게 일하고 있다) 사견임을 전제로 2021년은 되어야 업계에서 Pre-Cert를 활용할 수 있을 것이므로, 현재는 De Novo나 510(k)에 집중하는 것이 좋으며, 지금부터 Pre-Cert를 예측해서 뭔가를 하지는 말라고 조언해주었다.
하지만 De Novo로 인허가를 추진하는 것은 스타트업에게 역시나 큰 부담과 위험을 동반하는 일이며, 510(k)를 하려면 이 분야에서 기존에 인허가를 받아서 동등성을 입증할만한 predicate device가 없기 때문에 또 어렵다. 혹시 FDA De Novo를 하겠다는 스타트업은 Pear Therapeutics와 Akili의 케이스를 잘 살펴볼 필요가 있다. 이 회사들의 경우에 과거 수년간 임상 연구를 진행하고 논문을 내고, 인허가의 과정을 거친 후에야 겨우(?) 현재의 상태에 도달할 수 있었다. 과연 이렇게 추진하는 것이 맞는 것인가? 하지만 아래에 언급하겠지만, 진짜 문제는 그다음부터가 될 수도 있다.
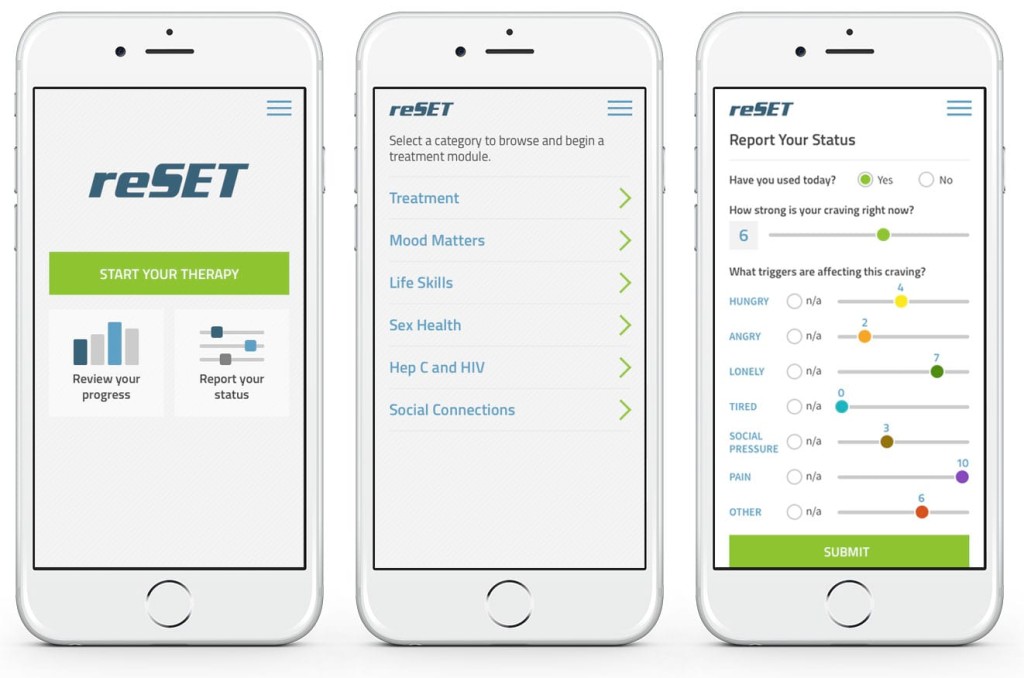 FDA 허가를 받은 Pear Therapeutics의 중독 치료 앱, 리셋(reSET)
FDA 허가를 받은 Pear Therapeutics의 중독 치료 앱, 리셋(reSET)
보험사는 어떻게 바라볼 것인가
이번 컨퍼런스에서 또 하나의 화두가 되었던 것이 바로 수가 적용(reimbursement)의 이슈이다. 보험사(Payer)는 이 디지털 신약을 어떻게 바라볼 것인지에 대한 실마리는 전혀 없는 상황이다. 기존의 약과 동일한 기준을 들이댈 것인가? 아니면 전혀 다른 새로운 기준을 만들어낼 것인가? 현재의 추이로 보아, 단순히 효능의 증명에 그치지 않고, 경제성에 대한 증명을 해야 한다는 것은 분명하지만, 수가 적용에 대해서는 불확실성이 매우 크다. 이 역시 개발사와 보험사 서로가 많은 시행착오를 거치면서 확립될 수밖에 없을듯 하다.
디지털 신약에서 수가를 주기 위한 효능을 어떠한 수치를 기준으로 판단할 것인지도 문제다. 단적인 예를 들어서, 눔(Noom)이나, 오마다 헬스 (Omada Health)의 당뇨병 예방 프로그램에 대한 CMS reimbursement 사례를 들 수 있다. 이 사례들의 경우 기존과 달리 ‘모바일 앱’에 기반하여 사용자 본인이 일상생활 속에서 식단 기록에 기반하여 체중 감량을 통해 당뇨병 예방 프로그램을 진행한다는 것이 골자이다. 그런데 이러한 경우에 ‘체중’이 직접적인 outcome이지만, 과연 환자들이 집에서 자기 스스로 측정하고 보고하는 체중을 Payer의 입장에서 신뢰할 수 있느냐가 이슈였다. 이 과정을 협의하는데 상당한 시간과 과정이 소요되었던 것으로 알고 있는데, 앞으로는 더 많은 시행착오를 거치게 될 것이다.
사실 이 보험사 관련 이슈는 해당 국가의 보험 체계에 따라서도 달라질 수도 있다. 최근 맥킨지의 디지털 신약에 대한 보고서를 보면 이 이슈에 대해서 단일 건강 보험 (single payer) 시스템이 오히려 신약에 유리할 수도 있다는 언급을 하고 있다. (과연 한국도 그럴까…) 특히 만성질환에 대한 장기적인 outcome을 고려한다면, 단기적인 효과를 기대하고 가입 기간도 상대적으로 짧은 사보험에 비해서, 더 장기적인 효과를 (예를 들어 10년 동안의 만성질환 관리에 대한 가치) 기다려줄 수 있는 단일 보험이 디지털 신약에 유리할 수도 있다는 지적이다. 하지만 반대로 말해서, 이는 개발사의 입장에서는 그 10년 동안의 가치를 먼저 증명해야 한다는 전제가 깔려 있다.
또한 패널 토의에서는 현재 여러 국가의 건보 재정이나, 고령화 등의 메가 트렌드를 보면 디지털 신약을 이용한 가치의 창출은 결국에 가야 할 방향이며, 특히 스케일을 키우기 쉬운 디지털 신약의 특성상 Payer들이 선호할 수 있는 측면이 있다는 점이 지적되기도 하였다.
의사가 처방할 것인가
이렇게 임상연구, 인허가, 보험수가 등의 첩첩산중을 넘었다고 해도 이제 큰 문제가 남아 있다. 바로 “의사가 게임을 정말 환자에게 처방할 것인가” 하는 문제다. 기존의 약을 환자에게 잘 처방하고 잘 쓰고 있는 경우라면, 의사가 굳이 디지털 신약을 환자에게 약 대신 처방하기는 매우 어려울 것이라고 본다. 특히 기존에 사용하던 약의 경우 작용 기전, 약효, 부작용, 사용법 등에 대해서 오랫동안 대규모 연구 결과가 축적되어 있는 경우가 많기 때문에 의사가 예상할 수 있는 정도의 리스크를 부담하고 적절한 통제 하에 활용할 수 있다.
따라서 의사의 입장에서는 디지털 신약에 대해서는 상대적으로 보수적인 입장을 취할 수밖에 없다. 즉, 잘못하면 새로운 디지털 신약을 개발하고, RCT로 증명해서, 인허가받고, 수가를 받는 과정을 수년에 걸쳐서 모두 달성했다고 하더라도, 의사가 처방을 해주지 않아서 망하는 사례가 나올 수도 있다. 사실 수년간의 노력으로 이러한 정석적인 루트를 거쳐온 Welldoc의 당뇨 관리 플랫폼 BlueStar 의 경우에도 이러한 어려움을 겪는 것으로 알려져 있다.
그렇기 때문에 디지털 신약이 기존에 쓰던 약, 혹은 first line therapy에 비해서 어떠한 장점을 가지는지를 고민해야 하며, 특히 그 장점이 ‘매우 유의미하게’ 좋지 않다면 의사가 처방하기를 꺼릴 것이라는 점을 명심해야 한다. 이러한 측면에서, 기존의 약으로는 잘 관리되지 않는 질병이나, 충분히 효과가 없었거나, 환자에게 좋지 않은 경험을 주었거나, 환자가 복용하면서 사후 관리가 중요함에도 RWD를 얻기 어려웠던 경우에는 디지털 신약이 매력적일 수 있다고 본다.
이러한 이유로, 의사가 처방을 주저하더라도, “환자가 처방 받기를 원하면” 의사의 태도가 바뀔 수도 있다는 점이 패널 토의에서 지적되기도 하였다. 따라서 의사를 직접적으로 설득하는 것뿐만 아니라, 디지털 신약이 환자에게 장점을 어필하여 환자를 먼저 설득하는 것도 중요하다는 점을 기억할 필요가 있겠다.
또 한 가지 문제는 바로 이러한 RWD, 즉 디지털 신약을 활용하면서 쏟아지는 데이터를 진료 환경에 어떻게 도입할 것인지다. 예를 들어, Akili 게임을 하면, 게임을 플레이할 때마다 게임을 했던 세부적인 데이터가 생산되는데, 이 데이터를 의사가 어떻게 활용할 수 있을까? 모든 환자에 대한 이 데이터를 누가, 어떻게, 언제, 어떤 방식으로 들여다볼 것인가?이 데이터는 EMR로 어떻게 통합되어야 하는가?
무엇보다 의사는 이미 데이터 속에 파묻혀서 고통받고 있는데, 현실적으로 의사가 이러한 디지털 신약의 RWD 까지 분석하는 것은 너무도 큰 부담이 될 것이다. 또한 그러한 데이터가 환자의 장기적인 치료 결과에 어떻게 영향을 줄지를 무엇을 근거로 어떻게 판단해야 하는가. 여기에 대한 답도 여전히 부족한 상황이며, 이 문제가 해결되지 않으면 그 RWD는 쓰레기에 불과할 수도 있다. 이렇게 되면 당연히 의사가 디지털 신약을 처방하기를 더 주저할 것이다.

ADHD 치료용 게임이 되려는 Akili.
2017년 말 povital clinical trial에서 primary endpoint를 달성하였고,
현재 FDA 리뷰 중이다. 내년 정도에 소식이 있을 것으로 본다고.
환자는 디지털 신약을 쓸까
그렇다면 환자는 어떠한가. 의사가 자신에게 약이 아닌 게임이나 앱을 처방해준다면 환자는 이를 받아들일 것인가. 임상연구, 인허가, 보험수가 등을 거치고, 정말로 의사의 처방까지 얻어내었다고 가정해보자. 이제는 환자가 정말로 이것을 써준다는 보장이 있어야 한다.
여기에 대해서는 환자의 디지털 리터러시(digital literacy)와 지속 사용성(engagement)이 매우 중요하게 된다. 디지털 리터러시는 예를 들어 디지털 기기에 익숙하지 않은 고령의 환자가 그러한 앱이나 게임을 제대로 활용할 수 있을지에 대한 것이다. 실제 디지털 헬스케어 관련 임상연구를 진행한 연구자들의 이야기를 들어보면, 사용자가 스마트폰 등에 얼마나 친숙한지가 연구 결과에 큰 영향을 미친다. 특히 디지털 신약이 고령층을 대상으로 하는 경우에 효과적일 것인지 고려해볼 필요가 있다. 반면, 소위 ‘디지털 네이티브’라고 불리는 스마트폰이나 태블릿PC 등의 디지털 기기에 익숙한 세대에게는 디지털 신약에 대한 거부감이 상대적으로 더 적을 수 있다. 이제 태어나자마자 스마트폰을 손에 쥐는 세대이니, Akili와 같이 아동을 대상으로 하는 경우는 타겟층을 디지털 리터러시 측면에서도 잘 잡았다고 할 수 있겠다.
또한 지속 사용성은 복약순응도(compliance)와 같이 그 앱을 환자가 정말 꾸준히 활용할 것인지에 대한 문제이다. 필자가 웨어러블에 관해서도 여러번 강조한 적이 있지만, 지속 사용성은 모두가 알고 있지만 너무도 풀기 어려운, 여전히 거의 아무도 풀지 못한 딜레마라는 점을 명심하자. 결국 디지털 신약에 대해서도 사용자 경험의 개선, 보험사와의 협업, 재정적인 인센티브, 의사나 전문 상담사의 코칭 등으로 풀어가야 하겠지만, 이것도 역시 해봐야만 알 수 있는 일이다.
- 관련 포스팅: 웨어러블 최대의 난제, 지속 사용성
다국적 제약사는 어떻게 받아들이나
이번 컨퍼런스에서 가장 활발하게 참여했던 주체 중의 하나는 바로 다국적 제약사였다. 노바티스, 사노피, 존슨앤존슨, 아스트라제네카의 디지털 신약 관련 부서의 담당자 (주로 부사장급), 그리고 이러한 제약사의 CVC 의 책임자들이 대거 참석했다. 이들은 각각 패널 토의 세션을 구성해서 다양한 논의를 쏟아내었다. 흥미롭게도 노바티스에는 Head of Digital Therapeutics, 사노피에는 Global Head of Digital Medicines 이라는 부사장급의 직책이 이미 있었고, 실제로 디지털 신약과 관련하여 상당히 많은 일을 추진하고 있었다.
디지털 신약 업계에서는 이러한 기존 다국적 제약사와의 관계 설정이 매우 중요하다. 반대로 다국적 제약사의 입장에서도 이러한 디지털 신약을 어떻게 받아들이고 활용할지가 큰 숙제 중의 하나이다. 이 역시 아직은 관계가 정립되지 않았으며, 이번에 참여한 제약사들의 경우에도 저마다 조금씩 다른 입장을 보여주기도 했다. 예를 들어서, 제약사가 이러한 디지털 신약을 내부적으로 개발해야할 것인가, 외부와 협력할 것인가. 이러한 신약을 stand alone으로 활용할 것인가, 혹은 기존의 전통적인 약에 대한 일종의 companion drug과 같은 형태로 사용할 것인가 등의 다양한 논의가 있었다.
실제로 디지털 신약은 그것을 stand alone 형태의 약으로 사용하는 것뿐만이 아니라, 기존의 전통적인 약을 환자가 복용할 때에, 복약 순응도(adherence)를 높이거나, 복용하는 동안의 환자 상태를 모니터링하고, 이를 통해 환자에 개인화된 치료나 관리를 제공하는 부분까지도 그 범위에 두고 있다. 예를 들어, DHP가 투자한 챗봇 헬스케어 스타트업 잴리랩(JellyLab)과 같이 약을 복용하는 과정에서 환자의 복약을 돕고 증상을 모니터링하며, 의료진과의 커뮤니케이션을 돕는 챗봇이 정확히 이러한 companion의 범위에 들어간다.
이러한 의미에서 이번에 참여한 제약사에서는 ‘바이오로직스에 디지털 신약이 포함될 수도 있고, 디지털 신약에 바이올로직스가 포함될 수도 있다’는 언급을 하기도 했다. 뿐만 아니라 FDA의 디지털 헬스 유닛 수장인 Bakul Patel의 발표에서도 디지털 신약의 범위를 언급하는 슬라이드에 이러한 companion drug 까지도 포함하였다.
더 나아가, 다국적 제약사들이 디지털 신약을 피할 수 없는 미래로 받아들이고 있으며, 이러한 미래를 준비하기 위해서 준비하고 있는 것은 공통적이다. 특히 CVC를 통해서 이러한 스타트업에 직접적으로 투자하는 것 또한 공통적인 움직임이다. 이 분야에서 선두라고 할 수 있는 Pear Therapeutics, Akili Interactive, Click Therapeutics 등이 모두 다국적 제약사로부터 펀딩을 받았으며, 펀딩 이후에 협업도 적극적으로 진행하고 있다.
디지털 신약을 개발하는 입장에서는 제약사와의 관계가 일단 ‘경쟁’이 아니라는 점은 명백해 보인다. 상술하였듯이 제약사는 이미 디지털 신약이 가보지 못한 개발의 전체 단계와 인허가, 수가, 처방 등을 거쳐서 환자에게 이미 가치를 제공하고 있다. 특히 보험사와의 협의, 의료계로의 딜리버리, 배포(distribution), 의사와 환자의 채택(adoption) 등의 측면에서도 엄청난 경험을 가지고 있으므로, 오히려 다국적 제약사와 적극적인 협력을 통해서 배워야 할 것들이 많다.
국내에서는 아직 제약사가 이러한 움직임을 거의 보여주지 못하고 있는 상황임을 고려해보면 (사실 이러한 분야가 존재한다는 것을 인지하고 있는지조차 잘 모르겠다) 이러한 미래에 더욱 적극적으로 동참할 필요가 있다고 생각한다. 또한 국내의 디지털 신약 스타트업의 경우에도 다국적 제약사와의 협력이나 CVC로부터의 펀딩을 적극적으로 추진해볼 필요가 있다. DHP에서도 적극적으로 이러한 관계를 만들기 위해서 노력하고 있다.
사노피의 CVC인 사노피 벤처스(Sanofi Ventures)의 Senior Director of Investments인 Ruchita Sinha는 필자가 일주일 전에 산타클라라에서 참석했던 Health 2.0에 이어서, 보스턴의 DTxDM 컨퍼런스에도 참석하여 디지털 신약에 대한 큰 관심을 보여주었다. Health 2.0에서 ‘한국 시장에도 관심이 있는가’를 물어보니 ‘아시아 시장에도 관심이 있으며, 상하이에 브랜치를 만들고 있다’며 에둘러 답변을 했다.
관심 있는 스타트업은 이런 쪽을 초기부터 적극적으로 태핑해보는 것도 좋다고 생각하며, DHP의 포트폴리오 스타트업에게는 이러한 기회를 적극적으로 제공해야겠다고 생각했다. 한국도 이러한 시장에 보다 적극적으로 진출해야 한다. 이 시장이 태동하고 있는 지금이 좋은 기회이며, 지금이 아니면 너무 늦을지도 모른다.
 우연한 기회에 함께 식사했던, AppliedVR의 CEO.
우연한 기회에 함께 식사했던, AppliedVR의 CEO.
이 회사에서는 VR로 ‘진통제’를 만들고 있다.

첫 번째 날의 마지막 순서였던, 칵테일 리셉션. 서로 네트워킹이 한창이다.
나가는 말
필자는 디지털 신약이라는 새로운 분야에 대해서 큰 관심을 가지고 있었고, 기회가 될 때마다 국내 제약업계나 연구자들에게도 이 분야를 적극적으로 소개하고 있다. 우연한 기회에 이 분야에서 일하는 다양한 사람들이 모이는 DTxDM 컨퍼런스를 발견하고 매우 기쁘고 들뜬 마음으로 참석했다. 아직 이 분야는 규모가 크지는 않기 때문에, 패널 토의에서도 지적되었듯이 ‘이 작은 방 하나에 이 분야 사람들이 전부 모인 것 같은’ 행사를 진행할 수 있었다. 필자도 그 일원이 될 수 있어서 아주 즐겁고 신나는 마음이었다.
특히 이 행사에서는 어떠한 시도들이 현재 일어나고 있는지를 한눈에 파악할 수 있는 기회임과 동시에, 스타트업, 제약사, 보험사, 의료계, 투자가 등의 다양한 이해관계자들이 이 새로운 분야에 대해서 어떠한 다양한 시각을 가졌는지를 볼 수 있는 좋은 기회였다.
사실 필자는 디지털 신약이라는 개념이 굉장히 fancy하기 때문에 관심을 가지게 되었다. 하지만 이번 컨퍼런스를 통해서 의료에 완전히 새로운 개념을 도입한다는 것이 얼마나 어려운지를 다시금 절실히 깨닫게 되었다. 여러번 언급하였다시피, 디지털 신약이 환자에게 최종적으로 가치를 주기 위해서는 “임상연구 – 인허가 – 보험수가 – 의사의 처방 – RWE 활용 – 환자의 사용”이라는 전체 과정 하나하나에 대한 큰 산을 여러 개 넘어야 한다. 이 길은 아직 아무도 가보지 않은 길이며, 개별 과정을 어떻게 해결해야 하고, 무엇이 좋은 길인지는 이 분야의 리더들 사이에서도 의견이 일치되지 않았다. 이 분야는 현재 갓 태동하는 단계에 있으며, 앞으로 이러한 각각의 과정에서 상당한 시간을 두고 많은 시행착오를 피할 수가 없어 보인다.
사실 이 분야에는 향후 큰 마일스톤이 될 수 있는 몇가지 중요한 뉴스가 올해 말과 내년 초 정도에 걸쳐서 나올 것으로 기대되고 있다. 게임으로는 최초로 FDA 인허가 및 처방을 노리고 있는 Akili의 인허가 관련이라든지, Pre-Cert의 워킹모델 확립, 몇몇 선두 회사의 임상 연구 결과 도출 등등이 바로 그것이다. 이 DTxDM은 상반기에는 미국 서부에서, 하반기에는 미국 동부에서 개최할 계획이라고 한다. 제3회 행사는 내년 2월 말 샌프란시스코에서 열린다. 그때 필자가 또 갈 수 있을지는 모르겠지만, 반년 뒤에는 또 새로운 뉴스들이 등장해있을 것 같은 느낌이 든다.
Discover more from 최윤섭의 디지털 헬스케어
Subscribe to get the latest posts sent to your email.