– 개별 제품이 아닌 제조사 기반의 규제를 유전자 DTC 검사에도 적용하는 방안
– 질병 위험도 DTC 검사를 ‘한 번’ 인허가 받은 회사의 후속 검사는 규제 면제 추진
– 한국의 유전자 DTC 규제 방식과의 괴리는 더욱 커질 전망
FDA는 지난 7월말 내어놓은 파격적인 ‘디지털 헬스 이노베이션 액션 플랜’의 Pre-Cert 프로그램에 이어서, 며칠 전에는 Scott Gottlieb 국장은 질병 위험도 유전자 검사의 DTC(Direct-to-Consumer) 서비스에 대한 일종의 Pre-Cert 안을 내어놓았습니다. 요즘은 기술의 발전도 따라가기 버겁지만, FDA의 규제 혁신 조차도 팔로업하기가 벅차다는 느낌이 듭니다. 그만큼 FDA가, 특히 국장이 Scott Gottlieb으로 바뀐 이후로 규제 혁신에 엄청난 박차를 가하고 있습니다.
제가 여러번 강조해드린 바 있듯이 Pre-Cert는 기존의 제품(product) 기반의 의료기기 규제가 아니라, 제조사(developer) 기반의 규제로 전환하겠다는 것입니다. 일정한 조건을 갖춘 기업에, 자격(certification)을 부여하고, 이 자격을 부여받은 기업은 소프트웨어 의료기기를 별도의 인허가 과정 없이, 혹은 매우 간소화된 과정을 거쳐서 시장에 출시하게 됩니다. 지난 8월부터 이 프로그램의 파일럿 테스트에 참여할 기업을 모집하였고, 9월에는 애플, 삼성, 버릴리(구글), J&J, 핏빗 등 9개 크고 작은 기업이 선정된 바 있습니다.
관련 포스팅
- 디지털 헬스케어 혁신을 위한 FDA의 혁신
- [발표자료] FDA는 디지털 헬스케어 혁신을 어떻게 규제하는가
- FDA의 디지털 헬스케어 Pre-Cert 파일럿에 삼성, 애플, 구글, 핏빗 등 선정
그런데 이번에는 다름아닌 유전자 테스트에도 이런 제조사 기반의 규제를 적용하겠다는 계획입니다. 특히 23andMe로 대표되면서 많은 논란과 규제 변화를 겪고 있던, 질병 위험도 (Genetic Health Risk) 의 DTC 검사가 대상입니다. 이 서비스는 암뿐만 아니라 고혈압, 당뇨, 심혈관질환 등 만성질환, 유전 질병 등 질병의 발병 위험도에 대해서 유전적인 분석을 일반인 들에게 제공하는 서비스입니다. 특히, 23andMe와 같이 DTC(Direct-to-Consumer), 즉 의료기관을 거치지 않고 환자가 직접 의뢰하고 결과를 받아보는 방식의 경우의 위험성 여부에 대한 논란이 컸습니다.
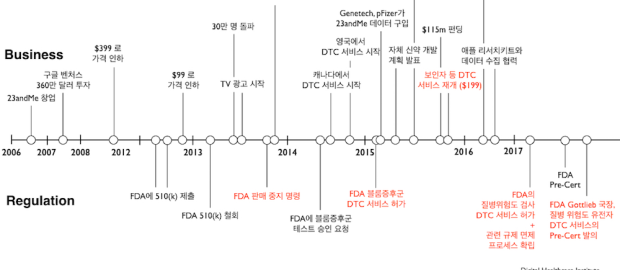
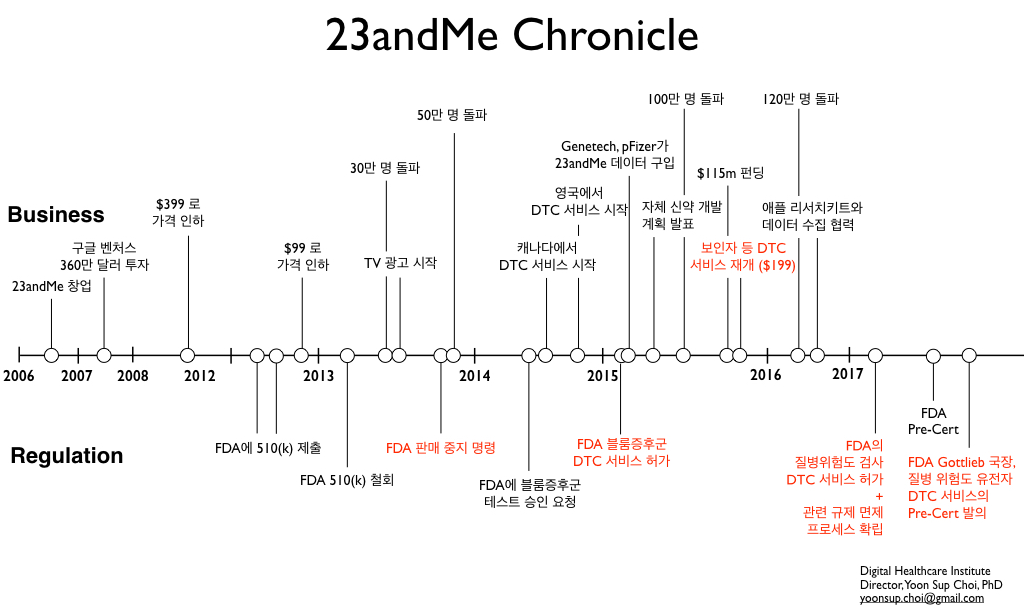
23andMe는 2013년 당시 수십개 이상의 질병위험도 유전자 검사를 DTC로 제공해오다가, 2013년 11월 돌연 FDA로부터 판매 금지 신청을 받습니다. 이후에도 DTC를 고집한 23andMe는 블룸 증후군 등 유전 질병에 대한 보인자 분석 (2015년 2월) 및 파킨슨과 알츠하이머 등 10개 질병(2017년 4월)에 대한 임상 검증 및 인허가 획득을 통해서, 점진적으로 예전의 서비스를 되찾아 가는 과정에 있었습니다. 기존 규제 시스템 하에서 새로운 서비스를 개척해나가는 퍼스트무버로서 23andMe가 총대를 맨 것이라고 할 수 있습니다.
관련 포스팅
- FDA가 23andMe에게 내린 판매 중지 명령의 배경과 의미
- FDA, 마침내 23andMe의 유전자 테스트를 승인: 그 의미와 전망
- FDA의 23andMe 질병 위험도 예측 DTC 서비스 허가와 의의
- 디지털 의료는 어떻게 구현되는가 (8) 개인 유전 정보 분석의 모든 것!
그러던 지난 2017년 11월 Scott Gottlieb 국장은 질병 위험도를 계산하는 DTC 유전자 검사의 인허가 역시 극히 간소화하는 방안을 내어 놓았습니다. 이 안에 따르면, 23andMe와 같은 기업이 질병 위험도 검사를 정해진 기준에 대해서 ‘한 번’만 인허가 받으면, 그 이후로는 같은 종류의 검사를 더 이상 pre-market review 없이 내어놓을 수 있습니다. (참고로, 이는 BRCA 등 ‘진단’ 목적의 검사에는 해당되지 않습니다)
23andMe와 같은 기업을 심사하는 과정을 거치면서 FDA도 중요한 교훈을 배웠다고 언급되어 있습니다. (23andMe가 적시되어 있지는 않지만, “GHR과 보인자 검사의 DTC를 처음으로 승인 받은 회사 (FDA’s authorization of the first GHR and carrier screening tests sold directly to consumers)”로 언급되어 있습니다)
이 역시 개별 제품 기준이 아닌 제조사 기반의 규제 방안으로, Pre-Cert 프로그램과 판박이라고 할 수 있습니다. 이 정책은 현재 Gottlieb 국장이 제안한 안건(a notice of intent) 정도의 형태이지만, 만약 이 안건이 승인되면 23andMe가 2013년 FDA 규제 이전에 해오던 100가지가 넘는 질병 위험도 검사 항목들을 즉시 DTC 서비스를 재개할 수 있을 것으로 보입니다. 질병 위험도를 검사하는 다른 회사의 서비스도 폭발적으로 시장에 쏟아져 나오겠지요.
아직은 안건 정도의 수준이지만, 이 정책이 시행되게 되면 한국 규제와의 갭은 또 한 번 크게 벌어질 것입니다. 한국은 현재 질병 위험성 검사는 커녕, 허용하도록 지정된 12개 항목들 이외에는 DTC는 불법입니다(더구나 검사할 수 있는 유전자 목록까지도 정해져 있습니다). 제가 항상 강조하지만 이 부분은 규제가 과도하다, 완화되었다의 문제가 아니라 규제를 하는 잣대 자체가 국내가 글로벌과 다르다는 것이 문제입니다.
이번 파격적인 안이 FDA에서 최종적으로 마무리되고 발효될지는 지켜봐야 하겠지만, FDA는 기술 혁신을 장려하기 위한 파격적인 규제 혁신을 지속적으로 해나가고 있습니다. FDA는 이런 제조사 기반의 규제를 다른 의료기기에 대해서도 계속 확대해 나가겠다고 합니다. 이런 것을 보면 부러우면서 좌절스러운 느낌이 동시에 듭니다.
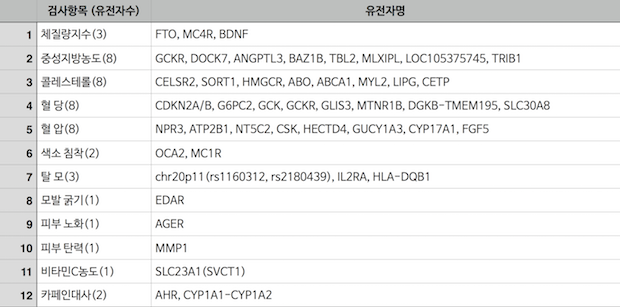 한국에서 DTC 허용된 12가지 항목 및 관련 유전자 목록
한국에서 DTC 허용된 12가지 항목 및 관련 유전자 목록
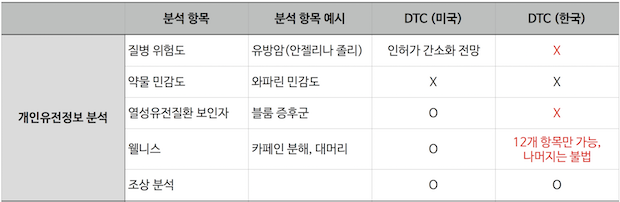 한국과 미국의 유전자 분석 DTC 비교
한국과 미국의 유전자 분석 DTC 비교
규제의 완화 정도보다, 규제의 잣대 자체가 국내가 글로벌과 다른 것이 문제
Discover more from 최윤섭의 디지털 헬스케어
Subscribe to get the latest posts sent to your email.