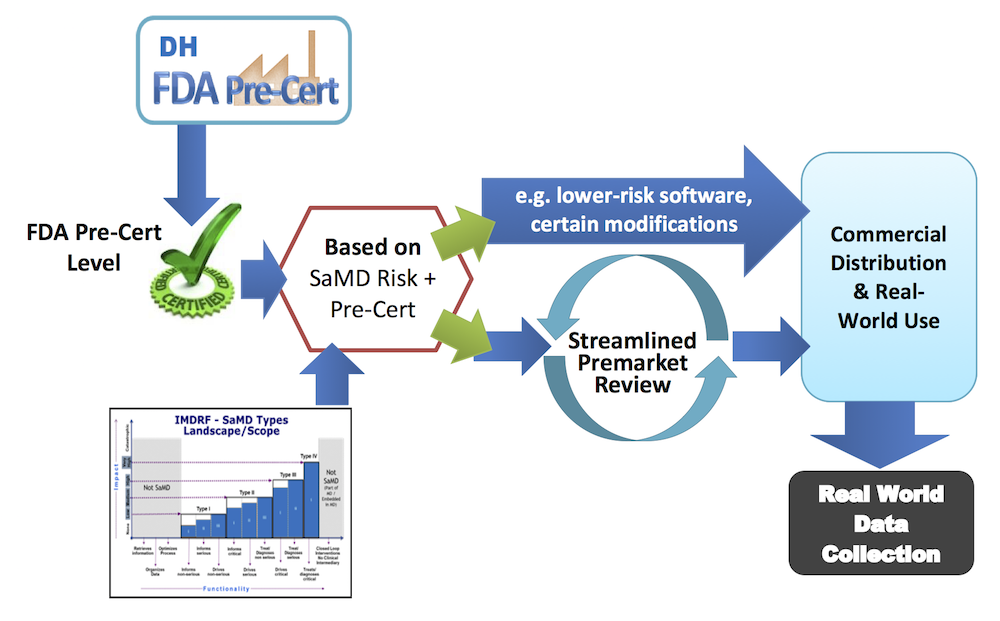
FDA가 지난 7월말 발표했던 ‘디지털 헬스케어 이노베이션 액션 플랜’의 pre-certification (이하 Pre-Cert)프로그램의 파일럿에 참여할 9개 기업이 선정되었습니다.
제가 블로그와 칼럼 등으로 정리해드렸다시피, FDA는 디지털 헬스케어 분야의 의료 기기에 대해서는 기존처럼 개별 제품(product)이 아니라, 제조사(developer)를 기준으로 규제하겠다는 파격적인 안을 내어놓았습니다. 적절한 자격을 갖춘 제조사에 일종의 인증인 Pre-Cert를 부여하면, 이 회사는 자신의 책임 하에 자율적으로 의료기기를 인허가 과정을 생략하거나 간소화된 과정을 거쳐서 시장에 제품을 출시할 수 있습니다.
이 정책에 관해서는 아래의 자료들을 참고하시기 바랍니다.
이러한 ‘Pre-Cert’ 정책은 상당히 파격적인 내용을 담고 있는만큼 파급효과와 부작용이 클 수도 있습니다. 예를 들어, 구체적으로 얼마나 엄격한 요건에 따라서 자격을 부여할지도 문제이며, 이 자격을 부여받은 회사가 위험도 높은 의료기기를 출시할 권리를 남용할 경우에 어떠한 책임을 어떻게 물을 것인지도 문제입니다. 이에 관해서는 초안에 명확하게 서술되어 있지 않았습니다.
큰 파급효과와 부작용의 소지를 FDA도 알고 있기 때문에, 지난 발표에서는 조만간 9개의 기업을 선정하여 파일럿 테스트를 시범적으로 진행해보겠다고 언급했습니다. 파일럿에는 저위험에서 고위험까지, 그리고 작은 규모부터 큰 규모의 기업을 골고루 포함하겠다고 계획을 밝혔습니다. 특히, 이 기업들은 ‘의료기기에 해당하는 소프트웨어를 개발하고 있거나, 개발할 계획이 있어야’ 합니다. 즉, 이 파일럿 테스트에 선정된 기업들은 내부적으로 향후 의료기기를 개발할 구체적인 계획을 가지고 있다고 봐도 무방할 것입니다.
선정된 9개 기업
지난 8월부터 Pre-Cert 파일럿에 참여할 기업을 모집을 시작하여, 어제인 9월 26일 FDA가 총 9개 기업을 선정하여 발표했습니다. 상당히 빠른 움직임이라고 보여집니다.
- Apple, Cupertino, California
- Fitbit, San Francisco, California
- Johnson & Johnson, New Brunswick, New Jersey
- Pear Therapeutics, Boston, Massachusetts
- Phosphorus, New York, New York
- Roche, Basel, Switzerland
- Samsung, Seoul, South Korea
- Tidepool, Palo Alto, California
- Verily, Mountain View, California
애플, 삼성, 버릴리(구글), 핏빗 같이 기존에 잘 알려진 회사도 있고, 처음보는 회사도 있습니다. 총 103개의 회사가 지원했다고 하는데, 그 중에 규모와 의료기기의 종류, 사업모델 등에 따라서 고루 선정한 것으로 보입니다. 아래와 같이 정리해볼 수 있지 않을까 합니다.
- 글로벌 테크 회사: 애플, 삼성
- 제약회사: J&J, 로슈 (사실 J&J는 기존에 의료기기를 만드는 회사이기도 합니다)
- 스타트업: 핏빗, Pear Therapeutics, Phosphorus
- 비영리: Tidepool (당뇨병 데이터의 공유를 추구하는 비영리재단입니다)
- 메디컬 회사: Verily (알파벳의 의료 관련 자회사)
주목해야 할 점은 앞서 언급하였다시피, 이 목록에 있는 기업은 적어도 내부적으로 향후 의료기기를 개발할 계획이 있는 기업이라는 점입니다. 이 글에서 이 기업들의 최근 움직임을 모두 자세히 분석하기는 어렵겠지만, 이 분야의 추이를 지켜봐온 분들이라면 상당히 흥미로운 점들을 찾아볼 수 있습니다.
애플과 핏빗, 버릴리
애플의 경우는 헬스케어 및 의료 연구 분야에는 헬스키트, 리서치키트, 케어키트와 애플워치의 심박센서 등으로 진출했다고 볼 수 있지만, 본인이 의료기기를 만들지는 않았습니다. 과거에도 혈당, 혈압 센서 등의 개발에 관한 루머들은 많이 있었고, 이번달 초 새롭게 발표되었던 애플워치에 혈당 측정 기능이 들어간다는 루머가 많았지만, 적어도 이번에는 사실이 아닌 것으로 밝혀졌습니다.
이에 대해서는 이 글에 자세히 다룬 바 있습니다만, 장기적으로는 충분히 가능성이 있다고 생각합니다. 대신, 이번 애플워치에는 심박수에 기반한 부정맥의 측정을 시도하겠다고 한 바 있습니다. 이는 당연히 의료기기로 분류되며, 이러한 부정맥 측정 기능을 향후 FDA Pre-Cert 프로그램을 통해서 개발된다고도 볼 수 있겠습니다.
- 관련 포스팅: 정말 애플 워치에 혈당 측정 기능이 들어갈까?
핏빗도 매우 흥미롭습니다. 핏빗은 기존에 웰니스 시장의 전반에 대한 포지셔닝을 구축하려 했지만, 그 결과는 그리 성공적이지 못했습니다. 포지셔닝이 너무 제너럴했고, 특정 세부 시장을 표적으로 하지도 않았습니다. 일반 사용자의 활동량 측정계에 대한 지속 사용성이 높지 않다는 것도 근본적인 문제입니다. 이 때문에 실적이나 주가도 그리 좋지 않은 상태입니다.
핏빗의 CEO 제임스 박은 작년부터 핏빗이 의료기기로의 진출 가능성을 내비치기도 했습니다. 사실 이는 웨어러블로서는 불가피한 선택이기도 합니다. 특히, 핏빗은 회사에서 유도하지 않았음에도 불구하고 의료, 신약개발 연구자들이 이미 활발하게 활용하는 기기였기 때문에 다른 웨어러블에 비해서 유리한 조건에 있었다고도 볼 수 있습니다. 작년 중순부터는 의료 연구자들에게 핏빗을 지원하는 전략을 시작했고, 다나파버 연구소의 유방암 연구 등을 공식적으로 지원하기에 이르렀습니다.
특히 최근에 핏빗은 심박 측정을 기반으로 한 부정맥의 측정 알고리즘 개발을 천명했고 (앞서 언급한 애플워치와 거의 동일한 기능인데, 발표는 조금 더 빨랐습니다), 가장 최근에 출시한 핏빗 아이오닉은 덱스콤의 연속혈당계 데이터를 디스플레이하는 기능을 추가했습니다. 과거의 매우 폐쇄적인 생태계를 가져가고, 의료기기와도 거리를 두던 핏빗으로서는 다소 파격적인 움직임이라고 할 수 있습니다. 더구나 이번 파일럿의 목록에 이름을 올림으로써 의료기기 분야로 진출하는 움직임을 본격화했다고도 할 수 있겠습니다.
알파벳(구글)의 자회사인 버릴리도 이름을 올렸습니다. 버릴리가 진행하는 ‘베이스라인 프로젝트’에 대해서는 몇번 소개해드린적이 있습니다. 4년 동안 만 명의 개인의 건강 상태를 다양한 테스트를 통해서 면밀하게 추적하여 데이터를 축적하여, 질병과 건강에 대한 인사이트를 얻겠다는 것이 이 프로젝트의 골자입니다.
축적하는 데이터는 두 가지 종류의 디바이스를 통한 심박수와 수면패턴 및 유전 정보, 감정 상태 (self-reported survey), 진료기록, 가족력, 정기적인 소변/타액/혈액 검사 등 다양한 데이터를 포괄합니다. 버릴리는 활동량 등의 측정을 위한 ‘Study Watch’ 를 개발하기도 했습니다. 이 시계는 심전도, 심박, EDA(electrodermal activity)와 관성 움직임(inertial movement) 등 심혈관계와 움직임과 관련된 질환에 대한 데이터를 측정한다고 되어 있습니다. 이 기기 역시 이번 파일럿을 통해서 의료기기화 하여 시장에 출시될 수도 있겠습니다. 참고로 버릴리는 지난 5월 지난 FDA의 수장인 로버트 칼리프(Robert Califf)를 영입하여 화제가 되기도 했습니다.
최초로 허가받은 디지털 신약, Pear Therapeutics
스타트업 중에는 Pear Therapeutics 가 이름을 올렸습니다. 이 회사는 며칠 전, 질병 치료 목적으로 최초로 승인 받은 ‘디지털 신약’으로 화제가 되었던 기업입니다. 즉, 기기 없이 소프트웨어, 즉 스마트폰 앱만으로 질병 치료 목적의 FDA de novo clearance 를 최초로 받은 것입니다.
reSET 이라는 시스템은 시스템으로 각종 중독을 치료하는 목적의 앱입니다. 12주에 걸쳐서 대마, 코카인, 알콜 중독에 대한 중독과 의존성을 치료한다고 합니다. 다만 아편에 대해서는 사용할 수 없고, 이 목적의 앱은 별도로 개발하여 clearance를 받을 것으로 예상되고 있습니다.
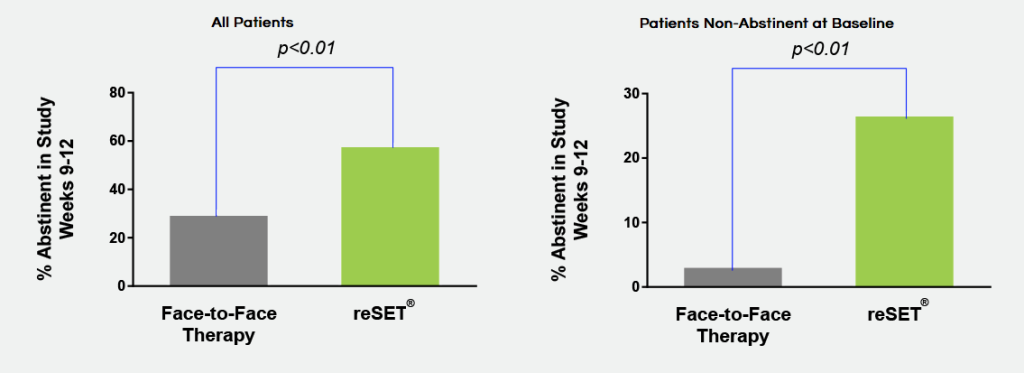
기존의 중독 치료에 대비하여 reSET이 월등한 효과를 보임
지금까지 다수의 randomized trial 에서 유의미한 효과를 보여줬다고 하며, 한 연구에서는 9-12주의 임상 결과 대조군에 비해서 약 두 배 많은 환자들이 중독을 치료할 수 있었으며, 환자의 참여율(retention) 역시 기존의 치료에 비해서 더 높게 유지되었습니다[ref]. 이런 회사는 의료기기 소프트웨어를 연구개발할 수 있는 역량을 이미 증명하였기 때문에 이번 Pre-Cert 프로그램의 취지에도 잘 맞는다고 볼 수 있겠습니다.
이번 FDA의 Pre-Cert 의 시행에 대해서 업계의 관심이 집중되고 있습니다. 이 정책이 어떻게 시행될지에 따라서 디지털 헬스케어 산업의 판도가 크게 바뀔 수도 있습니다. 특히 국내에서는 문재인 케어 등으로 국가 주도의 의료기기 산업의 불확실성이 높아지고 기업의 자율성은 낮아지고 있습니다. 반대로 미국에서는 기업의 자율성이 크게 높아지고 있기 때문에 국내외 시장 진출 전략에 대해서도 고민은 깊어질 것으로 보입니다.
또한 Pre-Cert 프로그램이 어떻게 시행될지에 따라서, 미국 내 자국 기업과 한국 등 해외 기업 사이의 규제 격차가 커질 가능성도 배제할 수 없기 때문에 귀추를 주목하는 것이 필요하겠습니다.
Discover more from 최윤섭의 디지털 헬스케어
Subscribe to get the latest posts sent to your email.