디지털 헬스케어 산업 분야에 있으신 분들, 특히 미국 시장에 진출하려고 하시는 분들은 이 뉴스는 꼭 보셔야겠습니다. 지난 7월 28일 FDA가 “Digital Health Innovation Action Plan” 이라는 혁신적인 플랜을 발표했습니다.
규제 기관이 디지털 헬스케어 산업계의 기술 혁신의 걸림돌이 되지 않고, 궁극적으로 환자에게 도움을 주기 위해서, 규제하는 방식을 혁신적으로 바꾸겠다는 것이 이번 발표의 골자입니다. 제가 유난을 떠는 것일 수도 있겠지만, FDA 발표자료를 손에 땀을 쥐면서 감탄사를 내지르며 읽기는 또 처음입니다.
아래에서 제가 요약하여 설명을 하겠지만, 관련되신 분들은 원문을 꼼꼼하게 읽어보시는 것을 추천해드립니다. 원문에 제가 줄쳐놓은 버전은 이 여기에서 보실 수 있습니다.
혁신을 어떻게 규제할 것인가
의료 산업의 많은 실무자들은 규제기관이 혁신의 걸림돌이 된다고 불만을 토로하곤 합니다. 규제가 합리적이지 않거나, 현실적이지 않고, 때로는 지나치게 엄격한 부분도 있으며, 무엇보다 임상 시험 및 인허가 과정을 거치기 위해서는 시간이 오래 걸리기 때문입니다. 이 때문에 기술 혁신의 결과물이 적시(timely)에 시장에 출시되지 못하는 현상이 발생하게 됩니다.
특히 디지털 헬스케어 분야는 이러한 문제가 더욱 심각합니다. 기술의 발전과 새로운 아이디어가 너무도 빠르게 나올 뿐만 아니라, 기존의 범주에 속하지 않는 종류의 서비스나 상품이 많기 때문에 규제하기가 어렵기 때문입니다. 특히 전통적으로의 ‘의료기기(medical device)’라는 것은 CT, MRI 기기나 체온계, 혈압계와 같은 하드웨어 기기를 의미했으나, 디지털 헬스케어가 부상하면서 의료기기의 정의는 스마트폰 앱, 딥러닝에 기반한 인공지능 등으로 비전통적인 기기(non-traditional medical tool)로까지 확대될 수밖에 없습니다.
이러한 상황에서 기존의 의료기기 인허가 (주로 하드웨어 기준) 잣대를 들이대자니, 혁신의 결과물이 환자에게 제때 적용되지 못하게 됩니다. 이는 열심히 기술을 개발해서 시장에 판매해야 하는 제조사에게 뿐만 아니라, 혁신적인 치료법이나 서비스를 기다리는 환자에게도 좋지 않은 일입니다. (이 부분에 대해서 이번 발표에서는 여러번 강조되고 있습니다) 그렇다고 해서 규제를 너무 완화하면 상용화되는 서비스의 안전성, 효과성이 보장될 수 없는 일이 벌어질 수도 있습니다.
이번 트럼프 정부에서 새롭게 부임한 FDA의 수장, 스콧 고틀리브(Scott Gottlieb)는 블로그에서 “비전통적인 의료기기를 전통적인 심사 기준에 따라 심사한다는 것이 FDA가 직면했던 고민이었다”며, “우리는 디지털 헬스케어 제품과 이러한 제품의 시장에 대한 유니크한 특성을 반드시 인식해야 하며, 이를 통해 디지털 헬스케어 기기의 ‘양질의’, ‘안전’하면서도, ‘효율적인’ 혁신을 장려해야 한다” 고 강조하고 있습니다.
트럼프 대통령은 바이오 산업의 규제를 대폭 철폐하겠다면서, 이런 방향으로 FDA를 이끌 ‘환상적인 인물’을 지명하겠다고 언급한 적이 있는데요. 그렇게 임명된 분이 이 스콧 고틀리브입니다. 그런 인물이 내어놓은 정책인만큼 정말 파격적인 내용을 담고 있는데, 그러면서도 혁신과 규제 사이에서 균형을 잘 잡은 것으로 보입니다.
사실 FDA는 몇년 전 부터 디지털 헬스케어 분야에서 기술의 발전을 수용하고 혁신을 저해하지 않도록 규제를 합리화하려는 노력을 계속해왔습니다. 몇년 전 웰니스 기기 관련 가이드라인, MDDS (Medical Device Data System) 규제 완화, 작년 가을에 각국의 규제 기관이 모인 IMDRF에서 SaMD(Software as a Medical Device) 가이드라인 제정, 오바마 정부 말기인 작년 12월에 21st century cure act 의 제정 등이 있습니다.
원문에는 FDA가 지금까지 해온 노력을 “What we’ve already accomplished” 라는 섹션에서 다루고 있습니다. 사실 이 하나하나의 움직임도 그동안 매우 주목할만한 것들이었습니다. (관련 분야에 계신 분들은 이미 익숙한 움직임들이시겠지만, 실무자 분이시라면 자세히 뜯어볼 필요가 있는 것들입니다)
디지털 헬스 이노베이션 액션 플랜
그런데 이런 움직임에 그치지 않고 FDA는 과거의 움직임들을 모두 종합하고, 한 걸음 더 나아가는 파격적인 액션 플랜을 내어놓았습니다. 아래의 세 가지이며, 여러 기사나 FDA 수장이 직접 블로그에 언급한 것을 보아도 핵심은 두 번째 항목입니다.
이러한 액션 플랜의 목적은 앞서 언급한대로 디지털 헬스케어 기술 혁신을 규제가 저해하지 않고, 기술 발전이 환자에게 주는 혜택을 극대화 하면서도, 동시에 퀄리티와 안전성을 유지하는 것이라는 점을 거듭 강조하고 있습니다.
1. Issuing new guidance implementing legislation
앞서 언급한 21th century cure act, IMDRF의 SaMD 가이드라인 등 관련 부분에 대한 규정을 각각 올해 말과 내년 1분기까지 등으로 더 업데이트하고 상세하고 명확하게(clarity) 만들겠다는 것입니다. 규정이 더 명확할수록 불확실성이 줄어들기 때문에, 기술을 개발하거나 사업 계획을 세우는 입장에서는 더 유리해집니다.
많은 관심을 모으는 IBM Watson 등의 Clinical Decision Support Software (CDSS) 에 대한 부분도 있습니다. 이 부분의 가이드라인은 2018년 1분기에 나오는 것으로 언급하고 있습니다. 업계에서는 CDSS에 대한 가이드라인을 오래 기다려왔는데 (다른 부분에 비해서) 이 가이드라인은 다소 때늦은 것이 아닌가 하는 지적이 있습니다.
2. Reimagining digital health product oversight
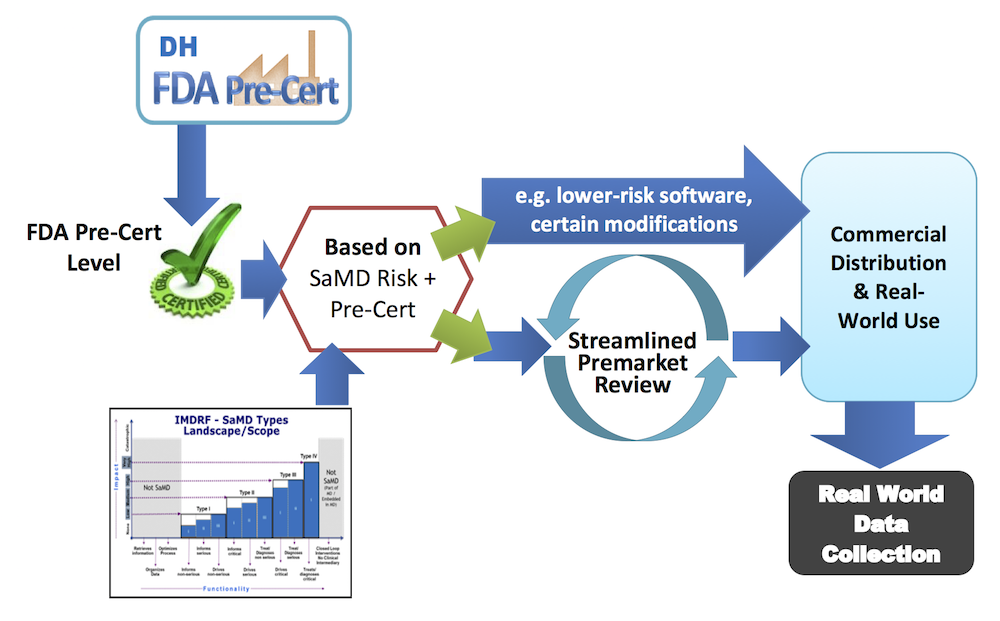
이 부분이 핵심입니다. (FDA의 표현에서 re-imagining 이라는 표현이 나온다는 것도 재미있습니다). 바로 디지털 헬스케어 기기에 대해서는 개별 “제품(product)”이 아니라, 개별 “개발사(developer)”에 기반하여 규제하는 프로그램을 시행하겠다는 것입니다.
즉, 적절한 자격 요건을 갖춘 회사에 “자격(pre-certify)”을 부여하고, 이 회사들이 만든 디지털 헬스케어 제품은 출시 전 인허가 과정을 면제받거나, 간소화된 인허가 과정(streamlined premarket review) 만을 거치게 된다는 안입니다. 이는 기존에 각각의 제품에 대해서 임상시험을 사전에 수행하고, 그 결과를 기반으로 인허가를 득한 후에 시장에 출시하는 방식을 완전히 뒤엎는 것이 됩니다.
이러한 안이 시행되게 되면, 자격 요건을 갖춘 제조사들은 보다 큰 자율권을 가지고 자신의 기술을 제품으로 만들어, 시장에 더욱 빠르게 출시함으로써 사업을 진행할 수 있게 됩니다. 자격을 인정받은 회사는 현재보다 더 적은 분량의 정보를 제출하거나, 혹은 아예 출시 전 심사 (premarket submission)을 하지 않아도 됩니다.
이를 통해 환자는 기술혁신의 수혜를 좀 더 빠르게 받을 수 있습니다. 이는 전형적인 미국의 네거티브 규제 철학이 적용된 것인데, 그 중에서도 좀 놀랍고 파격적일 정도로 진보적이라고 할만합니다. 기존에 비해서 신규 안이 수행되면 (자격 요건을 득한 기업의 입장에서는) 아래와 같이 바뀐다고 볼 수 있겠습니다.
- 기존: 개발 –> 임상 시험 –> 데이터 –> 인허가 –> 출시
- 신규: 개발 –> 출시 –> 데이터 (real-world data) –> 제출
특히 이렇게 pre-certify를 부여 받은 회사들은 시장에 제품을 출시하여, (FDA가 작년부터 많이 강조하고 있는) real-world evidence 의 축적에 이용할 수 있습니다. 완전히 새로운 제품은 전통적인 임상연구를 하기가 어려운 경우가 많기 때문에, 일단 시장에 출시해서 사용자들이 활용하면서 안전성과 효과성에 대한 데이터를 모으는 것입니다. 이러한 출시 후 데이터 (post-market data)는 FDA가 이 제품이 안전하고 효과적이라는 판단을 내리는데 도움이 될 수 있으며, 필요한 경우 추가적인 인허가에 활용될 수 있습니다.
다른 한 편으로는 구체적으로 무엇을 기준으로 ‘자격 요건이 되는’ 제조사들을 선정할지도 궁금해집니다. 인증 받은 회사와 인증 받지 못한 회사 사이에 엄청난 규제적 차별이 생길 수 있기 때문입니다. 반대로 자격 요건에 대한 문턱이 너무 낮으면 또 이런 프로그램을 시행하는 목적 자체가 훼손될 수도 있습니다.
어떠한 기준으로 자격 요건을 부여할 것인지는 조금 불명확하게 기술되어 있습니다. 소프트웨어 디자인, 개발, 검증, 유지 등에 대한 역량을 갖춘 곳을 선정하겠다는 것입니다. 이번 파일럿에서 FDA는 일단 최대 9개의 기업을 먼저 선정하여 이번 정책을 미리 테스트 해보겠다고 합니다. 이 9개의 기업에는 저위험 소프트웨어부터 고위험 소프트웨어를 만드는 다양한 규모(스타트업부터 대기업까지)의 기업이 포함될 것이라고 합니다.
스콧 고틀리브의 블로그에는 파일럿에 참여할 기업의 조건 및 의무에 대해서 아래와 같은 부분 들을 명시했습니다. 그 중 일부입니다.
- 의료기기의 범주에 해당하는 소프트웨어를 개발하고 있거나 개발할 계획이 있어야 한다.
- 소프트웨어 개발, 테스트, 유지에 대한 수치적으로 검증된 역량과 경험을 가지고 있어야 한다.
- 이 파일럿 기간 동안 회사들은 아래의 부분에 동의해야 한다.
- Real-world post-market data 를 수집하고 이를 FDA에 제공
- 실시간 상담을 위해 FDA와 미팅
- FDA의 현장 점검이 가능할 것
이 액션 플랜이 발표된 직후인 8월 1일부터 참여 기업의 모집을 받기 시작했는데요. 스타트업부터 대기업까지 고루 구성할 계획이라고 하니 어떤 기업이 선정될지 궁금합니다. 선정된 기업은 자사가 개발하고 있는 의료기기에 대해서 최단 시간에 시장 출시까지 노려볼 수 있게 되니, 저도 기대가 됩니다.
3. Growing our expertise
이 부분도 저는 매우 신선하게 보았습니다. FDA가 현재 디지털 헬스케어 산업의 기술 발전 수준을 따라가지 못하고 있기 때문에, 새로운 전문가를 확충하고, 재원의 규모도 늘려서 전문성을 더 강화하겠다는 것입니다. 이를 통해서 개별 제품과 회사에 대한 규제적 판단의 질, 예측가능성(predictability), 일관성(consistency), 적시성(timeliness), 효율성(efficiency)을 높이겠다고 언급하고 있습니다.
저는 이 부분을 읽고 매우 놀랐는데요. 그러니까, 규제기관이 공식적인 문서에서 자신들의 전문성이 기술 발전을 따라가지 못하고 있음을 인정하고, 앞으로 더욱 투자를 늘리고 노력을 기울여서 전문성을 높이겠다고 밝힌 것입니다. 이 부분이 저는 왜 이렇게 부러운지 모르겠습니다.
더 충격적(?)인 것은 EIR(Entrepreneurs in Residence, 초빙 기업가) 프로그램까지 운영을 하겠다고 합니다. 원래 EIR은 초기 스타트업 등의 조직에 창업에 성공 경험이 있는 선배 창업자가 상주하면서 경험, 전문성 등을 바탕으로 도움을 주는 것을 말합니다. 특히 벤처캐피털이 투자한 스타트업에 선배 창업자를 파견하는 식으로 미국에서 일반화된 제도이기도 합니다.
그런데 FDA가 EIR 프로그램을 운영하겠다는 것은, 정말로 자존심을 내려놓고 현장의 전문가들로부터 ‘배우겠다’는 겸허한(?) 자세를 보이고 있다고 봐야겠습니다. EIR을 운영함으로써 업계의 리더들 (thought leaders)과 소프트웨어 개발에 실제 경험이 있는 ‘외부’ 전문가들로부터 도움을 받아서 CDRH (Center for Devices and Radiological Health)의 전문성을 강화하겠다는 것입니다.
혁신을 위한 FDA의 혁신
이러한 FDA의 파격적인 변화가 매우 놀랍습니다. 규제기관이 변화해야 한다고 많은 현장의 전문가들이 목소리를 높이고 있지만, FDA가 이렇게까지 급진적(?)으로 변화한다는 것은 좀 예상 밖이기도 합니다. 이번 뉴스를 접한 업계 관계자들은 ‘실리콘밸리보다 오히려 FDA가 더 앞서가고 있다’며 환영하는 분위기라고 합니다.
FDA가 이렇게 바뀌게 되면 전세계의 규제기관도 당연히 영향을 받을 것으로 보입니다. 국내 식약처도 당연히 이러한 기조의 영향을 받는데요. 국내는 완전히 포지티브 규제에 기반을 두고 있기 때문에 어떤 식으로 대응을 할지 지켜봐야하겠습니다. 여튼.. 이렇게 기술의 혁신을 위해서 규제를 혁신하는 FDA의 모습에 부러운 마음이 드는 것은 어찌할 수 없네요.
Discover more from 최윤섭의 디지털 헬스케어
Subscribe to get the latest posts sent to your email.