최근 개인 유전 정보 분석 서비스(Personal Genome Service) 분야에서 오랜만에 희소식이 들려왔습니다. 지난 2017년 4월 6일 FDA가 23andMe의 질병 위험도 예측 서비스의 DTC (Direct-to-Consumer) 판매를 허가한 것입니다. 파킨슨병과 알츠하이머를 포함한 총 10가지 질병에 관한 인허가인데요. 이렇게 질병 위험도 예측 서비스가 의료기관을 거치지 않고 직접 고객에게 판매하는 DTC 형태로 허가받은 것은 미국에서도 이번이 처음입니다. FDA의 이러한 결정은 향후 개인 유전 정보 시장의 판도 및 규제 프로세스에도 영향을 줄 것으로 예상됩니다.
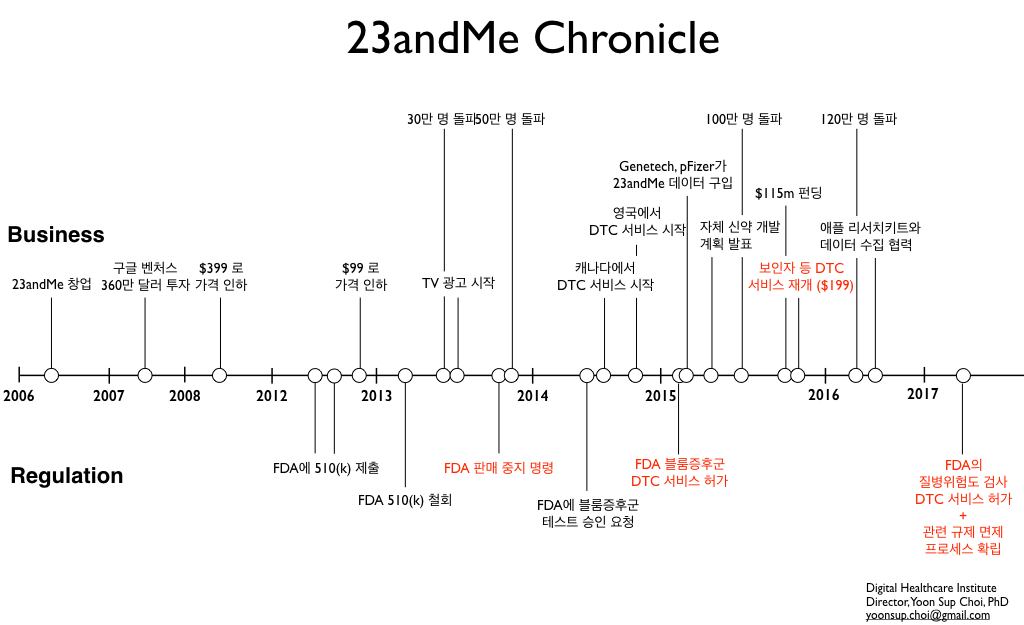
23andMe 연대기
제가 블로그에서 많은 지속적으로 팔로업 해드린 바 있듯이, 실리콘밸리 스타트업 23andMe는 2006년 창업 후에 많은 우여곡절을 겪으면서 개인 고객들에게 직접 유전 정보 분석 서비스를 제공해왔습니다. 창업 당시 구글 창업자 세르게이 브린의 아내였던 앤 워짓스키(Anne Wojcicki)가 공동 창업했던 이 회사는 개인 유전 정보 서비스라는 분야를 개척함과 동시에 구글과 세르게이 브린의 전폭적인 지원을 받으며 빠르게 성장합니다.
23andMe의 창업자, 앤 워짓스키
2013년 정도까지 23andMe의 고객은 폭발적으로 증가합니다. 유전 정보 분석이라는 생소한 서비스였지만 (의료기관이나 의사를 통할 필요 없이) 인터넷으로 주문하여 집으로 배달되는 타액 키트를 통해서 간단하게 이용할 수 있다는 점, $99 이라는 저렴한 가격에 이용할 수 있다는 점, 그럼에도 매우 다양한 항목을 분석해주었다는 점 등을 고객은 매력적으로 느꼈습니다.
당시에 23andMe가 $99에 분석해주었던 항목은 크게 아래의 다섯 가지 종류로, 개별 항목마다 한 단계 더 들어가면 세부적으로 수십에서 수백 가지의 분석이 포함되어 있습니다. 모두 합하면 세부적인 분석 항목은 무려 254가지나 되었습니다.
- 질병 위험도 (Health Risk)
- 약물 민감도 (Drug Response)
- 보인자 검사 (Inherited Conditions)
- 웰니스 및 신체적인 특징들(Wellness)
- 조상 계통 분석 (Ancestry Composition)
특히, 안젤리나 졸리가 2013년 5월 뉴욕 타임즈에 기고한 칼럼에서 유방암 유전자 검사를 통해 예방적 유방 절제술을 받았다는 것을 고백하면서, 유전 정보 분석을 통한 질병 위험도 예측에 대한 관심이 전 세계적으로 높아졌습니다. 이러한 분위기에 힘입어 23andMe의 인지도는 더욱 높아졌습니다.
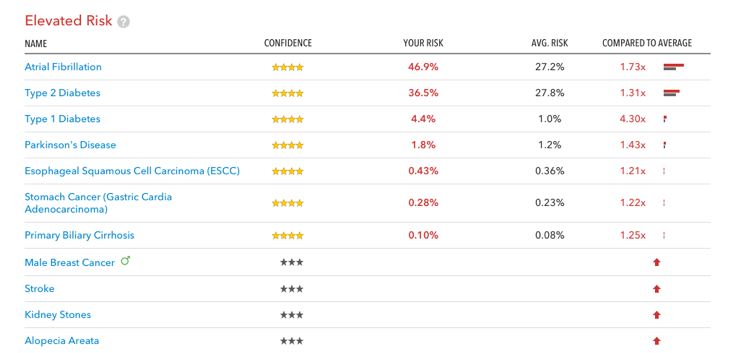 필자에게 위험도가 높은 질병 목록
필자에게 위험도가 높은 질병 목록
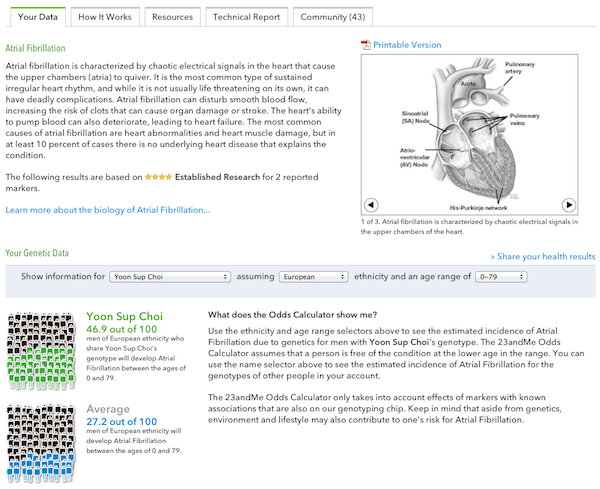 필자에게 위험도가 가장 높은 질병은 심방세동이다.
필자에게 위험도가 가장 높은 질병은 심방세동이다.
하지만 2013년 11월 23andMe는 별안간 FDA로부터 서비스 금지라는 철퇴를 맞게 됩니다. 정확성과 안전성이 검증되지 않은 의료 서비스를 (더 정확히는 의료기기(medical device)를) 인허가를 받지 않고 판매했다는 것입니다. 특히 FDA는 질병 위험도 예측, 약물 민감도 분석 등이 잠재적으로 환자에게 위험할 수 있음에도 불구하고 정확성이 검증되지 않았다고 지적했습니다.
완전히 새로운 개념의 서비스를 제공하는 23andMe는 이전에도 FDA와 오랜 기간 긴밀하게 협력을 해왔습니다. 하지만 FDA의 요구사항에 제대로 대응하지 못하고, 대규모 TV 광고를 진행하는 등 FDA 의 심기를 건드렸기 때문에 결국 판매 금지라는 큰 장애물을 만나게 된 것입니다. 이에 대해서 여러 전문가들은 이러한 규제가 적절했다는 것과 너무 과도하다는 쪽으로 의견이 나뉘었습니다.
사실 23andMe가 DTC 판매 방식을 고려하지 않고, 의료 기관을 통해서 판매한다면 이후로도 서비스를 계속할 수 있었습니다. 패쓰웨이 지노믹스 등 다른 경쟁사는 의료 기관을 통해서 지금도 계속 유사한 서비스를 제공하고 있습니다. 하지만 이 기업은 환자 본인에게 직접 유전 정보의 결과를 제공하고 데이터의 소유권을 가질 수 있게 하겠다는 미션으로 DTC가 아니면 사업을 하지 않겠다는 것을 고집했습니다. 결국 의료 서비스가 아닌 것이 확실한 조상 계통 분석을 제외하고, 다른 서비스는 모두 중단하게 됩니다.
절치부심한 23andMe는 단계별로 검사 항목에 대해 조금씩 FDA로부터 인허가받는 방식으로 예전의 서비스를 되찾기 위해서 노력하고 있습니다. 유전 질병의 인자를 가지고 있는지를 검사하는 보인자(carrier) 검사가 그 첫 번째였습니다. FDA의 금지를 받은 7개월 이후 23andMe는 블룸 증후군이라는 유전 질병 ‘하나’에 대한 보인자 검사 승인을 요청하였고, 2015년 2월에는 드디어 이를 허가받게 됩니다. 그에 따라 2015년 10월부터 블룸 증후군을 포함한 낭성 섬유증(cystic fibrosis), 겸상 적혈구 빈혈증(sickle cell anaemia), 테이-삭스 병(Tay-Sachs) 등 36가지의 유전 질병에 대한 보인자 테스트를 DTC 방식으로 재개하게 됩니다.
관련 포스팅:
- 23andMe의 개인 유전정보 분석 결과는 얼마나 정확한가?
- 23andMe, FDA의 판매 금지 명령 그 이후: 심사 요청, B2B 그리고 해외 진출
- FDA, 마침내 23andMe의 유전자 테스트를 승인: 그 의미와 전망
하지만 23andMe의 성장을 이끌었던 핵심적인 서비스인 질병 위험도 예측 검사는 여전히 DTC 서비스 허가를 받지 못하고 있었습니다. 이러한 질병 위험도 예측 검사가 드디어 FDA로부터 2017년 4월 6일 승인을 받은 것입니다. 이에 따라 2013년 11월 철퇴를 맞았던 질병 위험도 예측 검사가 3년 반 만에 다시 시작할 수 있게 되었습니다.
이번 포스팅에서는 이 뉴스를 중점적으로 다루어드리려고 합니다만, 이 뉴스가 가지는 의미를 이해하기 위해서는 간략히 상술해드린 23andMe가 거쳐온 역사를 살펴볼 필요가 있습니다. 사실 23andMe의 역사가 개인 유전 정보 분석 서비스 업계의 역사라고 해도 과언이 아닙니다. 이 부분에 대해서는 “디지털 의료는 어떻게 구현되는가 (8) 개인 유전 정보 분석의 모든 것!” 포스팅에 자세하게 정리되어 있으니 참고하시기 바랍니다.
질병 위험도 예측 DTC 허가
이번에 23andMe가 질병 위험도 예측에 대해서 DTC를 허가받은 것은 아래의 10가지 질병에 대해서입니다.
- 파킨슨병 (Parkinson’s disease)
- 알츠하이머 (Late-onset Alzheimer’s disease)
- 셀리악병(Celiac disease): 글루텐을 소화하지 못하는 질병
- 알파-1 항트립신 결핍증 (Alpha-1 antitrypsin deficiency) 폐와 간의 질병 위험도를 높일 수 있는 질환
- 조발성 1차성 근긴장이상증 (Early-onset primary dystonia)
- XI 혈액응고인자 결핍증 (혈우병C) (Factor XI deficiency, a blood clotting disorder)
- 제 1형 고셔병 (Gaucher disease type 1)
- 포도당-6-인산탈수소효소(G6PD) 결핍증 (Glucose-6-Phosphate Dehydrogenase deficiency)
- 유전성 혈색소침착증(Hereditary hemochromatosis): 철분 과잉 흡수 장애
- 유전적 혈전 기호증(Hereditary thrombophilia): 혈전 장애
23andMe는 이번 질병 위험도 검사의 인허가를 받기 위해서, 해당 검사의 안전성(safety), 정확성(accuracy), 효과성(effectivness)을 검증하기 위해서 다방면으로 노력하였던 것으로 보입니다. FDA의 공식 발표와 여러 언론에 보고된 바를 종합해보면, 아래와 같은 점이 포함되었던 것으로 보입니다.
- 검사하는 유전적 변이가 개별 질병의 위험도에 영향을 준다는 명확한 연구 결과. 이러한 데이터는 질병에 걸린 사람의 집단과 걸리지 않은 사람의 집단을 비교 분석하여 이끌어낸 결론
- 23andMe의 타액 키트를 통해서 수집한 샘플로 정확하고 일관적으로 유전 변이를 발견(identification)할 수 있다는 것을 증명
- 영국에서 25,000명에게 (알츠하이머 및 파킨슨병을 포함한) 질병 위험도 예측 서비스를 DTC로 제공한 결과, 자해 등 위험한 결과가 한 건도 발생하지 않았음
- 사용자들이 질병 위험도 예측의 결과 레포트에 포함된 내용의 90% 이상을 이해함
이러한 부분들을 전문적인 용어로는, 분석적 타당성(analytical validity), 임상적 타당성(clinical validity), 임상적 유용성(clinical utility)을 검증했다는 것인데요. 이러한 부분들은 2013년 말까지 23andMe가 FDA에게 적절하게 입증하지 못했던 부분입니다. 그동안 23andMe가 얼마나 절치부심했는지를 엿볼 수 있는 부분입니다.
 23andMe의 타액 수집 키트
23andMe의 타액 수집 키트
새로운 규제 기준과 프로세스
이번 인허가를 어떠한 시각으로 바라봐야 할까요? 파급효과가 미미할 것이라고 볼 수도 있습니다. 왜냐하면 이번에는 단지 10개의 질병만 승인을 받았기 때문에, 2013년 11월 FDA의 철퇴를 맞기 전까지 시행하던 120여 개의 질병 중에 극히 일부만을 재개한 것에 지나지 않기 때문입니다. 더구나 당시에는 암, 당뇨병, 심혈관 질환 등 까지도 분석한 것에 비해, 이 10개 질병의 대부분은 일반인들에게 낯선 희귀 질환입니다.
하지만 이번 FDA의 결정 및 인허가 과정은 여러모로 의미심장하며, 그 파급효과는 앞으로 더 클 수 있습니다. 이번 FDA의 인허가는 소위 de novo 과정을 거쳤습니다. de novo는 ‘신규, 새로이’라는 뜻을 지닌 라틴어인데요. 이러한 인허가 과정은 기존에 비교할만한 유사한 기기가 없으면서도, 낮거나 중간 정도의 위험도(low-to-moderate-risk device)를 가지는 경우에 적용됩니다. 즉, 완전히 새로운 개념의 기기에 맞게 별도의 허가 프로세스를 밟았다는 것입니다.
또한 FDA는 이번 허가와 함께 ‘스페셜 컨트롤 (special control)’ 이라는 기준을 확립했다고도 밝히고 있습니다. 이는 해당 기기에 대해서 FDA가 어느 정도의 정확성(accuracy), 안정성(reliability), 의학적 타당성(clinical relevance)을 가지기를 기대하고 있는지를 명확히 한 것입니다. 다시 말해, 이런 ‘스페셜 컨트롤’이 충족되면 유사한 질병 위험도 검사에 대해서도, 합리적인 수준의 안전성(safety)과 효용성(effectiveness)을 보장할 수 있다는 것입니다.
이러한 과정은 결국 23andMe의 질병 위험도 예측의 DTC 판매라는 완전히 새로운 개념의 서비스를 심사하기 위해서 규제 기관인 FDA 측에서도 상당한 고심 끝에 새로운 기준까지 명확하게 만드는 유연성을 발휘했다고 볼 수 있습니다. 완전히 새로운 개념의 서비스에 대해서 규제 기관이 기존에 가지고 있던 기준과 원칙을 들이대면 상식에 맞지 않거나 불합리하게 규제될 수 있습니다. 혹은 이러한 기준 자체가 모호하거나 없는 불확실한 경우도 적지 않습니다.
비합리적이고, 불합리하고, 불명확한 규제는 결국 기술 혁신의 가장 큰 걸림돌이 됩니다. 따라서 새로운 개념의 의료 서비스와 기기에는 이를 심사하고 규제하는 기준 자체를 새롭고, 명확하고, 합리적으로 규정해야 할 필요가 있습니다.

더 나아가, 이번 인허가는 단순히 23andMe의 10개 질병에 대한 인허가에서 그치지 않습니다. 이번 de novo 심사 과정 및 스페셜 컨트롤 등의 과정을 거쳐서, FDA는 향후 유사한 종류의 질병 위험도 예측 검사에 대해서 시장 출시 전 심사 (premarket review)를 면제해주기로 했습니다. 즉, 이번에 해당 종류의 기기를 심사하기 위한 기준을 명확하게 세웠기 때문에 추후 다른 업체의 다른 질병의 위험도 예측에 대해서도, 동일한 수준의 근거를 마련하면 굳이 심사를 받을 필요가 없다고 한 것입니다.
이는 지난 2015년 2월 23andMe가 블룸 신드롬으로 보인자 테스트에 대해서 DTC 서비스를 최초 승인 받았을 때와 유사합니다. 당시에도 이후의 보인자 테스트에 대해서도 FDA는 비슷한 수준의 근거를 갖추면 출시 전 심사를 면제해주기로 한 바 있습니다. 이러한 결정에 따라서 23andMe는 8개월 이후 36가지의 유전 질병에 대한 보인자 검사를 DTC 방식으로 출시한 바 있습니다.
이에 따라서, 23andMe는 예전의 질병 위험도 예측 검사를 다시금 회복할 수 있는 규제적인 토대를 마련했습니다. 일단은 이번에 허가 받은 10개의 질병으로 시작하겠지만, 동일한 수준의 정확성, 안전성, 효용성에 대해서 근거를 마련할 수만 있다면 다른 질병들에 대해서도 서비스를 위험도 예측성 검사를 추가할 수 있게 되었습니다. 이에 따라, 관련 업계에서 관련 서비스가 다시 활발해질 것으로 예상합니다.
다만, 이러한 규제 프로세스의 간소화에 대해서 진단과 관련되는 유전 정보 검사는 포함되지 않았습니다. 예를 들어, 안젤리나 졸리의 BRCA 유전자의 경우, 유방 절제술과 같은 의학적 처치의 근거가 되므로 이번과 같은 규제 면제에서는 제외될 것이라고 FDA는 명시하고 있습니다. 이러한 FDA의 설명을 근거로 예상해보면, 진단이나 의학적 처치에 직접적으로 연관되지 않고, 분석의 정확성 등에 근거만 명확하다면 예전의 질병 예측성 검사를 상당부분 빠르게 회복할 수도 있을 것 같습니다.
23andMe의 현명한 대응
저는 이번 뉴스를 보면서 여러 가지를 많이 느꼈습니다. 무엇보다 이제 노련미까지 느껴지는 23andMe의 규제기관에 대한 체계적인 대응입니다. 2006년 창업한 23andMe는 벌써 11년 차의 중견 스타트업(?)이 되었으며, 기업가치가 $1 billion을 넘는 유니콘이 되었습니다.
사실 23andMe는 2013년 11월 금지 명령을 받은 이후로, 질병 위험도 분석에 대해서는 별다른 뉴스를 내어놓지 않으며, 이 시장에 대한 재진입을 포기한 듯 보였습니다. 하지만 이번 결정으로 보아, 인허가에 필요한 근거와 데이터를 수집하면서 지속적으로 노력해온 것이 드러났습니다.
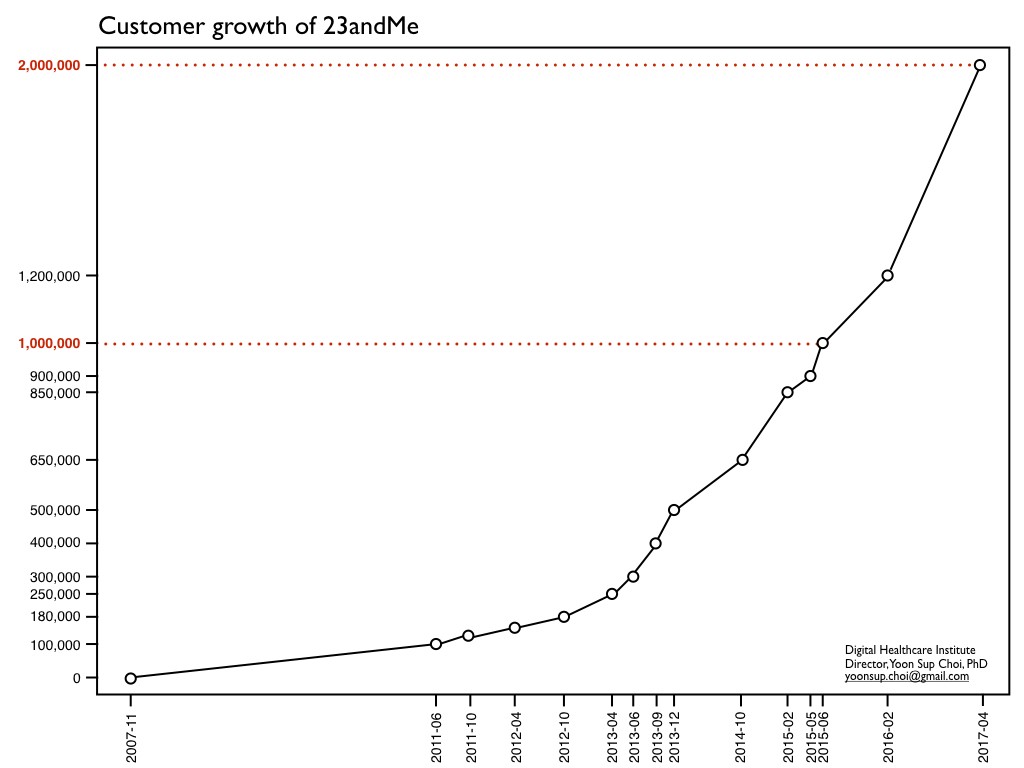
23andMe는 현대 의학의 엘리트주의를 무너뜨리고, 환자 본인에게 자신의 DNA 정보를 소유할 수 있게 하겠다는 미션으로 서비스를 중단할지언정, DTC를 미련할 정도로 고집해왔습니다. 그러한 미션은 갖은 고초를 겪으면서 계속해서 성장해왔습니다. 최근에는 사용자 수가 200만 명을 돌파했다고도 발표했습니다. 그럼에도 불구하고, 예전에는 FDA의 프로세스에 공개적으로 불만을 표시하는 등 규제와 관련해서는 파격적이지만 세련되지 못한 이미지가 있었습니다.
23andMe의 고객은 이미 200만 명을 돌파했다
하지만 지난 몇년 동안 이러한 부분에 큰 보완이 있었던 것으로 보입니다. 예전에 부족했던 FDA와도 긴밀하게 협력했을 것 같습니다. 특히 de novo process에 대해서는 정확성, 안전성, 효과성 등에서 기존에 비교할만한 검사가 없으므로 FDA와 더욱 긴밀하게 커뮤니케이션 하면서 협업을 해야 했던 것으로 보입니다.
특히 제가 인상 깊었던 것은 “일반 사용자가 레포트에 적시된 내용 중 90% 이상의 내용을 이해할 수 있다” 는 것을 증명했다는 부분입니다. 2013년 11월 경고문에서 FDA는 질병 위험도 및 약물 민감도 분석의 결과를 일반인이 잘못해석하여 오남용할 수 있는 위험이 있다는 것을 명시적으로 언급했습니다. 이러한 부분에 대해서 23andMe는 철저하게 대비한 것으로 보입니다.
또한 해당 경고 서한에서 문제가 되었던 아래와 같은 부분들도 23andMe는 확실하게 근거를 만들거나, 설득할 수 있는 논거를 제기한 것으로 보입니다.
- 의사를 통하지 않는 DTC 방식에 대한 우려
- 이러한 서비스의 정확성 및 안정성에 대한 우려
- 결과를 받은 사용자들이 제대로 이해할 수 있을지, 오남용에 대한 우려
- 특히, BRCA 유전자에 대한 검사
이러한 부분의 준비가 가능했던 또 한 가지 이유는 2013년 당시보다 질병의 위험도를 더 정확하고 안전하게 검사하기 위한 더 많은 연구 결과들이 쏟아져 나왔기 때문입니다. 당시에는 위험하거나 근거가 부족했던 검사가, 그동안 진전된 연구를 통해서 상황이 달라졌을 수 있습니다. 스크립스 중개과학연구소의 소장인 에릭 토폴 박사는 “지난 FDA의 사태 이후 유전적 질병 위험도 관련 많은 연구 결과가 일류 저널에 출판되었다” 고 언급하기도 했습니다.
더욱 커지는 국내 규제와의 괴리
이렇게 앞서가는 FDA의 규제 개선은 국내 식약처의 규제 현황과의 괴리를 더욱 크게 만들고 있습니다. 현재 한국에서는 네거티브 규제에 의해서 질병 관련 검사는 물론이고, 일반적인 웰니스 검사도 지정된 항목의 지정된 유전자 이외에는 엄격하게 DTC 검사가 금지되어 있습니다.
2016년 중순까지만 해도 국내에서 유전정보 검사를 하기 위해서는 분석 목적을 막론하고 반드시 의료 기관을 거쳐야만 했습니다. 암과 같은 질병의 예측이든, 대머리 유전자의 검사든, 카페인 민감도의 검사든 말입니다.
사실 국내 관련 업계에서는 비의료기관, 즉 일반 기업도 소비자를 상대로 DTC로 유전 정보 분석 서비스를 제공하는 것이 오랜 숙원이었습니다. 개인 유전정보 분석 시장이 폭발적으로 성장하고 있는 미국에 비해 국내 시장의 성장은 미미한 것도 소비자 대상의 직접 서비스가 원천적으로 막혀 있기 때문이라는 지적이 많았습니다.
복지부는 이 문제에 대해서 고심해왔으며, 2015년 12월 ‘생명윤리 및 안전에 관한 법률’ 개정에 이어, 2016년 1월 업무보고에서 ‘질병 예방 목적의 일부 유전자 검사를 비의료기관에서 직접 실시’ 하는 것을 허용할 예정이라고 공식적으로 발표하였습니다. 그 결과 ‘비의료기관 직접 유전자검사 실시 허용 관련 고시’가 제정되며 2016년 6월 30일부터 ‘제한적’으로 DTC 유전자 검사 서비스가 허용되기에 이르렀습니다.
이렇게 세계적인 흐름에 발맞춘다는 미명 하에 6월 30일에 DTC 유전자 검사에 대해서 일부분이 허용되었지만, 허용 항목이 너무도 제한적이어서 산업적으로나 의학적으로 별다른 의미가 없습니다. 산업계에서 DTC 허용을 요구하는 목소리에 대응하는 듯했지만, 실제 허용된 항목을 보면 너무도 제한적인데다가, 검사 가능한 유전자 목록까지 규정되어 있습니다. 즉, 별로 바뀐 것은 별로 없는 것입니다.
하루가 다르게 유전학 분야에서는 연구 결과가 쏟아지고, 근거는 쌓여 가는데 2007년에 대통령 령으로 정해놓은 검사 금지 유전자 항목도 사실상 여전한 실정입니다. 다소간에 규제가 완화되는 부분도 없지는 않지만, 실질적으로 일선 기업이나 환자들의 입장에서는 미미한 수준입니다.
더 큰 문제는 규제를 위해 들이댄 잣대 자체가 FDA 등 글로벌 규제 기조나 산업계에서 통용되는 기준과는 전혀 다르다는 것입니다. 복지부의 고시에 나오는 유전자의 목록을 들여다보면, 앞서 23andMe를 예시로 설명한 질병/약물/보인자/웰니스/조상 분석 등의 업계에서 받아들여지는 분류와는 기준이 완전히 다릅니다.
더 구체적으로 들어가면, 미국에서 허용된 23andMe의 보인자 검사의 DTC 서비스는 여전히 한국에서 불법입니다. 또한 이번 FDA의 결정에 따라서 질병 위험도 검사 역시 미국에서 허용되었지만, 한국에서는 여전히 불법으로 남아 있습니다. 글로벌 규제와의 국내 규제의 격차가 더욱 커지고 있는 셈입니다.
필자는 국내의 규제가 글로벌 수준보다 더 합리적이고, 더 선도적이 될 것까지는 기대하지 않지만, 최소한 글로벌에서 통용되는 체계나 수준과는 발맞춰가는 것이 필요하다고 봅니다. 하지만 6월 30일의 DTC 일부 허용이나, 생명윤리 및 안전에 관한 법률 시행령’ 개정안을 보면 글로벌 수준에 발맞추기는 커녕, 한국에서만 통용되는 자체적인 별도 규제 분류 체계를 갈수록 더 만들어가고 있습니다. 출발도 잘못되었고, 거기에 덕지덕지 새로운 개정안을 덧붙이다보니, 갈수록 글로벌과 완전히 다른 방향으로 가고 있습니다.
이렇게 갈수록 더욱 갈라파고스가 되어가는 국내 규제에서 피해를 보는 것은 결국 국내 기업입니다. 미국에서 조만간 23andMe의 질병 위험도 DTC 분석 서비스가 시작되면, 한국인들도 구매 대행을 통해서 타액을 미국으로 보내어 이 서비스를 이용하는 것도 가능해질 것이다. 즉, 한국인들이 미국 기업의 서비스를 이용할 수는 있지만, 정작 한국 기업은 이 서비스가 원천적으로 금지되어 있는 것입니다. 결국 역차별인 셈입니다.
이번 23andMe와 FDA의 결정을 보면 경외감과 부러움까지 드는 반면, 눈길을 국내로 돌리면 한숨만 자꾸 나오는 이유입니다.
Discover more from 최윤섭의 디지털 헬스케어
Subscribe to get the latest posts sent to your email.