논란의 유니콘, 테라노스 (Theranos) 가 갈수록 사면초가에 몰리고 있는 형국입니다. 테라노스는 ‘피 한 방울’ 로 240여 가지의 진단을 수시간 내에 진단할 수 있다고 주장하며 삽시간에 실리콘밸리에서 가장 촉망 받는 기업으로 떠올랐습니다.
특히, 아직 31세에 불과한 미모의 여성 창업자이자 CEO인 엘리자베스 홈즈 (Elizabeth Holmes) 가 과거 스탠퍼드 대학교 화학공학과를 2학년 때 자퇴하고 10여년간 ‘스텔스 모드’ 로 비밀리에 이 기술을 개발해왔다는 것이 알려지면서 이 기업은 더욱 주목 받았습니다. 지금까지 $400m 을 투자 받았으며, 기업 가치는 $9b 에 달하는 기업입니다. 이 기업가치는 미국 전체 스타트업 중 13위이며, 생명과학/헬스케어 분야에서는 단연 1위 입니다.

테라노스의 창업자이자 CEO, 엘리자베스 홈즈 (출처: Fortune)
하지만 이 테라노스는 지나친 비밀주의로 많은 논란과 의심을 받아왔습니다. 분석법 및 기기 등 내부적인 프로세스는 ‘기업 비밀(trade secret)’로 간주되며 철저하게 베일에 쌓인 채 있었습니다. 일반적으로 생명공학기업이 진행하듯 논문 출판이나 FDA 승인을 통한 정확성, 안전성 검증도 극히 일부를 제외하면 진행된 것이 없었습니다.
지난 포스팅에서 설명드렸듯이, 저는 이 기업에 대해서 별로 관심을 두지 않았/못했었습니다. 왜냐하면 외부적으로 공개된 논문이나 데이터가 거의 없었기 때문에, 공부해보려고 해도 할 수 있는 것이 없었기 때문입니다. 또한 과학자들은 데이터가 없으면 믿지 않게 마련입니다.
지난 10월 초, 월스트리트 저널은 테라노스의 내부 사정에 대한 폭로 기사를 내어 놓으면서, 이 회사에 대한 의구심을 더욱 증폭시켰습니다. 테라노스를 퇴사한 익명의 내부자와 전문가들의 말을 빌려, 이 회사의 기술이 실체가 없거나 매우 과장되었을 수 있으며, 분석의 정확성 역시 크게 의심된다는 것이었습니다. 특히, 내부적으로 개발한 분석 기기인 ‘에디슨’은 200여가지 분석 항목 중 일부 밖에 사용되지 않으며, 분석 검증 과정에서 연방법을 위반한 소지가 있다는 내용이었습니다.
이 내용에 대해서는 제 블로그의 지난 포스팅을 참고하시기 바랍니다.
월스트리트 저널의 기사로부터 시작된 논란 이후, 테라노스를 둘러싼 여러 여건들이 빠르게 변화하고 있습니다. 테라노스가 그동안 주장해왔던 것이 거짓이거나 최소한 매우 과장되었을 가능성이 높다는 여론이 형성되며, 다방면에서 검증에 대한 거센 압력을 받고 있는 것입니다.
월그린즈, 테라노스에 대한 조사 시작
미국의 최대 약국 체인, 월그린즈 (Walgreens) 는 테라노스가 분석 서비스를 판매하는 대표적인 채널입니다. 대형 약국 내에 차려진 테라노스의 ‘웰니스 센터’ 에서 의사 없이 약사나 보조원이 혈액 몇 방울을 채취하는 것입니다.
사실 테라노스의 빠른 성장은 월그린즈의 입점에 전적으로 의지했다고 해도 과언이 아닐 정도입니다. 미국 전역의 8,240 여개 지점을 통해 많은 환자를 직접 대면할 수 있는 접근성 높은 채널이기 때문입니다. 테라노스는 월그린즈를 통해서 2013년 9월부터 파트너십을 맺으며 진단 서비스를 제공하기 시작했습니다. 현재 피닉스 주에 42개, 캘리노피나에 2개, 펜실베니아에 1개의 웰니스 센터를 가지고 있습니다. 또한 월그린즈는 테라노스의 지분도 일정 부분 가지고 있는 것으로 알려져 있습니다.
테라노스 서비스의 정확성에 대한 논란이 증폭되자, 월그린즈는 해당 분석 기술에 대한 의문이 해결되기 전까지는 테라노스의 분석 센터를 더 이상 늘리지 않겠다고 공식 발표했습니다. 뿐만 아니라, 월그린즈는 자체적으로 테라노스의 과학적, 법적 이슈를 조사하기 위한 팀을 만들었다고도 전해지고 있습니다.
월그린즈 관계자에 따르면, 일반적으로 외부의 의료 관련 파트너사와 협약을 맺을 때에는 사전에 기술의 정확성 등에 대한 검증을 거치지 않았다고 합니다. 테라노스 딜은 “다른 루트로 내려왔다 (went down a different route)” 라고 언급하고 있기도 합니다.
테라노스와 월그린즈의 파트너십은 원래 서로에게 윈윈할 수 있는 전략이었습니다. 테라노스로서는 효과적인 고객 점점을 찾을 수 있을 뿐만 아니라, 월그린즈에게는 매장에 더 많은 고객들을 끌어들일 수 있는 유인책도 되기 때문입니다.

월그린스의 내부 구조. 매장 뒷편에 약국 코너가 보입니다
미국의 월그린즈나 CVS 등은 ‘약국’으로 분류되지만, 그 구조는 한국의 대형 마트에 가깝습니다. 매장의 뒷단 (구석)에는 약사들이 근무하는 약국이나, minitue clinic 같은 소형 병원 등이 있습니다만, 매장 입구에서 약국까지 걸어가는 동안 음료수, 스낵, 화장품, 생필품, 건강보조식품 등 일반 마트와 별반 다를 바 없는 품목들을 지나가야 합니다. 약국 체인으로서는 더 많은 사람을 ‘매장 안쪽’ 까지 끌어들일 수 있으면, 마진이 높은 약 이외의 일반 품목들을 고객에게 노출 시킬 수 있으므로 그만큼 이익이 되는 것입니다.
월그린즈의 조사 결과가 어떻게 나올지는 지켜봐야 하겠지만, 테라노스로서는 가장 큰 판매 채널의 향후 확장에 제동이 걸리면서 타격을 입을 수 밖에 없게 되었습니다. 앞으로 월그린즈 이외의 새로운 판매 채널을 뚫거나 병원에 직접 서비스를 판매하는 모델을 확장시켜야 할텐데, 기술의 신뢰를 잃은 상황에서 이 마저도 당분간은 용이하지 않아 보입니다.
홈즈, ‘논문 출판을 통한 검증을 받겠다’
CEO 엘리자베스 홈즈는 테라노스의 데이터를 논문으로도 출판해서 검증을 받겠다고 밝혔습니다. 지난 포스팅에서 언급해드린대로, 테라노스의 논문은 저명학술지라고는 할 수 없는 Hematology Report 에 2014년 4월에 출판한 것 하나가 전부입니다. 그마저도 분석 항목의 수, 사용한 분석 방법 등에서 테라노스의 기술을 증명하기에는 무리가 있는 수준이었습니다.
반면 지난 10월 26일 클리블랜드 클리닉이 주최한 Medical Innovation Summit 에서 홈즈는 앞으로 테라노스의 데이터로 논문을 출판할 계획이 있다고 언급했습니다. 이에 관해 앞으로 자세한 일정을 밝히지는 않았습니다만, 그럼에도 불구하고, 이는 분명 그동안 테라노스가 지향해왔던 바와는 전혀 다른 움직임입니다.
혁신적인 의료 서비스로 유명한 대형 병원인 클리블랜드 클리닉은 테라노스와 기술을 함께 개발하는 파트너십을 맺기도 했습니다. 하지만 클리블랜드 클리닉의 병원장 Dr. Delos M. Cosgrove 에 따르면, 기술을 공동 개발하는 것에 합의는 있었지만, 현재 병원에서 이 기술을 사용하고 있지는 않다 (“not used the technology on our campus at this point.”) 고 밝혔습니다.
테라노스의 대변인은 향후 테라노스의 손끝에서 뽑은 피에서 얻은 결과와 기존의 혈관에서 채취한 혈액 검사의 결과를 비교하는 데이터를 출판할 것이라고 밝혔습니다. 사실 테라노스의 주장에 따르면, 회사 내부적으로는 이렇게 기술의 정확성에 대한 데이터를 모두 확보해놓은 상태이어야 합니다. 기술의 정확성을 검증하지 않은 상태에서 외부에 서비스를 하지 않았을리는 없기 때문입니다. (만약 검증 없이 서비스를 시작했다면 그 자체로 큰 과학적/윤리적 문제가 될 것입니다.)
사실 테라노스 홈페이지에도 이미 기존의 검사 방식과 자사의 검사 결과가 일치한다는 그래프를 올려놓기도 했습니다. (지난번에 지적했듯이 실험 방법 등에 대해서는 아무런 정보가 없기는 합니다만) 만약 이 데이터가 모두 합리적인 방법 하에 얻어진 것이라면, 이것을 단순히 논문화 하는 것에는 그리 오랜 시간이 걸리지 않을 것입니다. 이 결과가 과연 논문으로 어떻게 나오게 될 것인지는 앞으로 지켜봐야 하겠습니다.
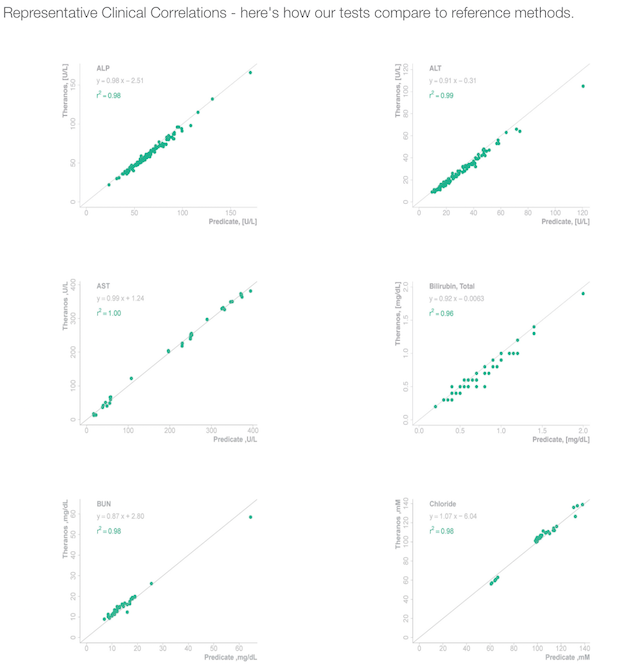
테라노스 홈페이지에 소개된 결과 검증 데이터 (출처: 테라노스)
FDA, 테라노스에 칼을 뽑아들다
테라노스에게 가장 큰 타격을 주고 있는 것은 역시 FDA 입니다. 미국에는 LDT (Laboratory Developed Test) 를 FDA 승인 없이도 허용하는 규정 때문에 테라노스의 분석 서비스 제공 자체에 대해서는 규제가 어렵습니다. 하지만 FDA가 자신의 제한적인 권한이라도 활용해서 이 논란이 되는 서비스를 규제하기 위해서 여러 가지 방안을 내어놓고 있는 것으로 보입니다.
10월 27일 FDA는 테라노스에 대한 두 개의 조사 보고서를 공개했습니다. (조사 레포트 1, 조사 레포트 2) 공개된 보고서에는 상당 부분이 가려져 있기 때문에 세부적인 내용을 파악하기는 어렵습니다만, 핵심적인 부분은 아래의 두 가지 이슈입니다.
- 테라노스의 작은 혈액 채취 기기인 ‘nanotainer’ 는 FDA 승인을 받지 않은 의료 기기
- 고객들의 불만이나 품질 관리 체계 (quality control procedure) 의 문제점들이 해결되지 않고 있음
FDA는 지난 8월 25일부터 9월 16일까지 불시에 테라노스를 조사했던 것으로 알려져 있습니다. 이는 지난 7월 테라노스가 단순 포진 바이러스 (herpes simplex virus) 검사에 대한 FDA 승인을 받은 이후의 일이었습니다.
이 보고서의 양식은 Form 483 reports 으로 FDA의 조사 이후에 일반적으로 발행하게 되는 형식이라고 합니다.( 2014년 9월을 기준으로 지난 12개월간 의료기기에 대해서 발행된 Form 483 reports 는 총 972 편이라고 합니다) 흔히 심각한 문제가 있을 경우 판매 중지 등을 명령하기 위해서 보내는 FDA의 경고 편지 (Warning Letter) 보다는 덜 심각한 문서이지만, 이번 보고서에서 제기된 문제들이 제대로 해결되지 않을 경우에는 추후 Warning Letter 를 받을 수도 있을 것 같습니다.
이 보고서들에서 FDA는 테라노스에 대해 총 14개의 문제들 (observations) 을 지적했습니다. (자세한 내용은 가려져서 파악이 어렵습니다만) 품질 관리 프로세스와 서류 기록, 기기 (machinery)와 테스트에 대한 문제들이 언급되어 있습니다. 테라노스는 제기된 이슈들 중 13개에 대해서 문제를 시정했거나, 시정할 것을 약속했다고 합니다.
FDA, ‘nanotainer 는 승인 받지 않은 의료기기’
특히, 문제는 nanotainer 에 관한 것입니다. 이 작은 용기를 통해서 혈액을 몇 방울 검사한다는 것이 테라노스 서비스의 핵심입니다. 하지만, FDA는 이 nanotainer가 ‘승인 받지 않은 의료기기 (uncleared medical device)‘ 라고 판단하고 있습니다.
지난번 포스팅에서 테라노스는 월스트리트 저널의 기사 이후에 240여가지 분석 서비스에 대해서 nanotainer 의 사용을 중단하는 것으로 바뀌었다고 말씀드렸었습니다. 계속 nanotainer를 사용하는 유일한 예외는 FDA 승인을 받은 단순 포진 바이러스 (herpes simplex virus) 검사입니다. 당시 기사에서 테라노스 측은 이러한 변화에 대해서 FDA로부터 아무런 공식적인 경고를 받지 못했다고 했지만, 이번에 드러난 바로는 반드시 그렇지만은 않은 것 같습니다.
FDA는 nanotainer 를 Class II 의료 기기로 판단하고 있다고 합니다. 이는 매우 중요한 부분입니다. 왜냐하면 Class II 의료기기로 분류받게 되면, 라벨링(labeling), 성능에 대한 표준 (mandatory peformance standard), 시판 후 감시 (post-market surveillance) 등을 의무적으로 받아야 하기 때문입니다. 즉, FDA의 규제 하에 있는 것이지요.
반면, 테라노스는 nanotainer 를 Class I 의료기기로 판단했다고 합니다 (사실 FDA와 아무런 협의 없이 자체적으로 이렇게 판단했다는 것도 좀 의아한 부분입니다만). 위험도가 낮은 의료기기에 매겨지는 Class I 의료기기는 대부분 FDA로부터 허가를 받을 필요 없이 서비스가 가능합니다.
참고로 FDA 에서는 의료 기기를 안전성과 효능 확인에 필요한 규제 수준에 따라, 아래와 같이 3가지 등급으로 나누어서 규제를 하고 있습니다 (참고1, 참고2).
- Class I: 일반규제 (General controls)
- 인체에 건강과 안전에 심각한 위험을 주지 않는 비교적 단순한 기능의 용구
- 모든 의료기기에 적용되는 [일반규제]만 받는 것으로 가장 규제가 느슨한 의료기기
- Ex) 반창고, 칫솔, 설압자, 붕대, 관장기구, 희석용기구 등
- Class II: 일반규제 및 특별규제 (General controls and Special controls)
- 안전성 및 유효성을 보증하기에는 충분치 않지만 기준을 만드는데 충분한 정보가 있는 의료기기
- 시장에 이미 판매 되고 있는 제품과 성능 및 안전 측면에서 동등함을 입증하여야 함.
- 대부분의 의료 기기에 해당
- Class III: 일반규제 및 시판 전 허가 (General controls and PMA)
- 인체의 건강과 안전에 심각한 영향을 끼칠 수 있는 의료용구
- Class Ⅰ, Class Ⅱ 의 일반통제는 반드시 거쳐야 함은 물론 판매전 승인(premarket approval)을 받아야 함
- Ex) 전원부착 체외페이스 메이커, 자동 헤파린 애널라이저, 심폐장치, 피임용 자궁내 경구 등
- Class Ⅲ 제품은 통지만으로도 미국 시장에 진출할 수 있는 Class Ⅰ, Ⅱ 와 달리 FDA 승인을 받은 후에만 진출 가능
결론적으로 테라노스는 Class II 의료기기를 FDA의 승인을 받지 않고 서비스를 한 것이 됩니다. 보고서에 따르면, “귀사는 승인 받지 않은 의료기기로 캘리포니아, 아리조나, 펜실베니아 등의 주들을 넘나들며 서비스를 하고 있다 (You are currently shipping this uncleared medical device in interstate commerce, between California, Arizona, and Pennsylvania)” 고도 언급되어 있습니다.
이러한 사정에 따르면 테라노스가 단순 포진 바이러스 (herpes simplex virus) 이외의 테스트에 대해서는 더 이상 nanotainer 를 사용하지 않기로 한 결정에도 이해가 가는 부분입니다.
이상 테라노스를 둘러싼 일련의 이슈들에 대해서 추가적으로 정리해보았습니다. 갈수록 테라노스의 기술을 공개적으로 검증받지 않을 수 없는 쪽으로 상황이 흘러가는 것 같습니다. 엘리자베스 홈즈도 공개적으로 논문을 출판하겠다고 밝혔고, FDA가 규제를 하는 이상 사업을 계속 하기 위해서는 데이터를 공개하여 정식으로 승인을 받는 수 밖에 없을 것입니다.
저는 개인적으로 테라노스의 실체가 없다는 쪽으로 생각하고 있지만, 엄밀히 말해 과학적인 견지에서 본다면 아직 아무런 데이터가 없는만큼 실제로 기술이 존재한다고도, 존재하지 않는다고도 섵불리 판단을 내리기는 어렵다고 봐야겠습니다. 이런 점을 교묘히 이용하고 있는지는 모를 일입니다만… 향후 앞으로 어떤 행보를 보일지를 지켜보는 수 밖에 없지 않을까 합니다.
Discover more from 최윤섭의 디지털 헬스케어
Subscribe to get the latest posts sent to your email.























[…] 테라노스, 점점 더 수세에 몰리다: 월그린즈, 클리블랜드 클리닉, 그리고 FDA […]