(“FDA, 모바일 헬스케어 규제 완화 (1) 웰니스/의료기기 구분“에서 이어지는 글입니다)
의료 기기 액세서리에 대한 가이드라인
뿐만 아니라, FDA는 같은 날 ‘의료 기기의 액세서리 (medical device accessories)’에 대한 별도의 가이드라인도 내어 놓았습니다. 이 가이드라인은 의료 기기 본체(parent device)와 함께 사용되는 액세서리의 경우, 그 액세서리가 종속되어 사용되는 본체와 액세서리를 각각 별도로 규제하겠다는 것입니다.
만약에 의료기기 본체가 Class III 등급의 규제를 받는다고 하더라도, 액세서리 자체는 더 낮은 리스크를 가진다면 본체와 동일한 Class III 가 아니라 Class II 등급에 해당하는 규제를 받을 수도 있다는 것입니다. 이는 의료 기기에 대한 앱을 만드는 기업들에게 호재로 작용할 것으로 보입니다. 기존에는 의료기기 본체에 준하는 규제를 받아야만 했다면, 이제는 앱 자체의 리스크에 기준하여 더 낮은 정도의 규제를 받을 수도 있기 때문입니다.
참고로 FDA 에서는 의료 기기를 안전성과 효능 확인에 필요한 규제 수준에 따라, 아래와 같이 3가지 등급으로 나누어서 규제를 하고 있습니다 (참고1, 참고2).
- Class I: 일반규제 (General controls)
- 인체에 건강과 안전에 심각한 위험을 주지 않는 비교적 단순한 기능의 용구
- 모든 의료기기에 적용되는 [일반규제]만 받는 것으로 가장 규제가 느슨한 의료기기
- Ex) 반창고, 칫솔, 설압자, 붕대, 관장기구, 희석용기구 등
- Class II: 일반규제 및 특별규제 (General controls and Special controls)
- 안전성 및 유효성을 보증하기에는 충분치 않지만 기준을 만드는데 충분한 정보가 있는 의료기기
- 시장에 이미 판매 되고 있는 제품과 성능 및 안전 측면에서 동등함을 입증 하여야 함.
- 대부분의 의료 기기에 해당
- Class III: 일반규제 및 시판 전 허가 (General controls and PMA)
- 인체의 건강과 안전에 심각한 영향을 끼칠 수 있는 의료용구
- Class Ⅰ, Class Ⅱ 의 일반통제는 반드시 거쳐야 함은 물론 판매전 승인(premarket approval)을 받아야 함
- Ex) 전원부착 체외페이스 메이커, 자동 헤파린 애널라이저, 심폐장치, 피임용 자궁내 경구 등
- Class Ⅲ 제품은 통지만으로도 미국 시장에 진출할 수 있는 Class Ⅰ, Ⅱ 와 달리 FDA 승인을 받은 후에만 진출 가능
Dexcom의 스마트폰 앱, 규제 등급 하향 조정
이러한 의료기기 액세서리에 관한 가이드라인의 제시에 따라, Dexcom의 혈당 모니터링 어플리케이션은 즉각적인 수혜를 받게 되었습니다. 미국 샌디에고에 본사를 두고 있는 Dexcom은 혈당을 연속적으로 측정할 수 있는 기기(continuous glucose monitor, CGM)를 만드는 대표적인 회사입니다.
이 연속 혈당 측정기는 작은 실 형태의 센서를 복부에 부착 및 삽입하여 혈당을 5분마다 자동적으로 측정합니다. 즉, 혈당을 거의 실시간으로 측정하면서, 수치가 어떻게 변화하는지를 연속적(continuous)으로 모니터링할 수 있습니다. 기존의 손가락 끝에 피를 내어서 혈당을 측정하는 방식은 비연속적 (non-continuous) 입니다. 이는 한 순간만의 혈당 수치를 측정하기 때문에 혈당이 변하는 추이를 실시간으로 모니터링할 수 없다는 단점이 있습니다. 이러한 기존의 방식이 ‘사진’을 찍은 것이라면, Dexcom의 연속 혈당 측정기는 ‘동영상’ 을 찍는 것이라고 할 수 있습니다.
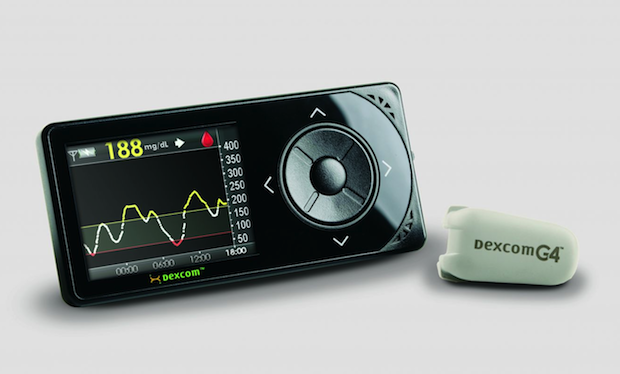 Dexcom의 혈당측정계(오른쪽) 및 휴대용 수신기
Dexcom의 혈당측정계(오른쪽) 및 휴대용 수신기
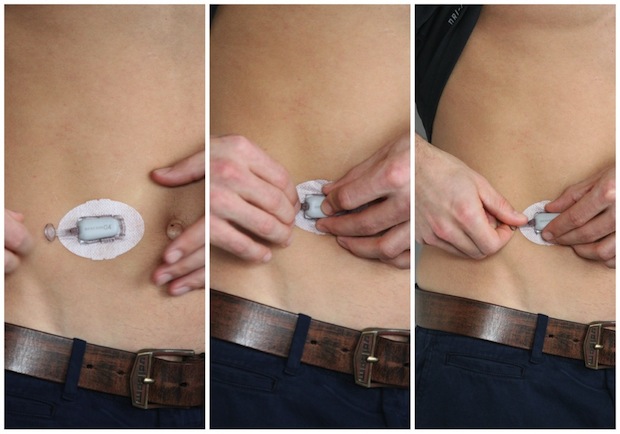 Dexcom의 혈당측정계를 복부에 착용한 모습
Dexcom의 혈당측정계를 복부에 착용한 모습
이 센서는 측정한 데이터를 20피트 (약 6미터) 내에 있는 전용 수신기에 전송하게 되며, 사용자는 이 수신기의 스크린으로 혈당 수치의 변화를 모니터링할 수 있습니다.
이 Dexcom의 연속혈당 측정기는 대표적인 모바일 의료기기 중의 하나로 손꼽히며, 애플의 HealthKit 플랫폼에 통합되는 기기이기도 합니다. 또한, 세계에서 가장 먼저 HealthKit 플랫폼을 이용하여 만성 질환 환자 관리 연구를 시작한 스탠퍼드 대학병원이 사용하는 기기가 바로 Dexcom의 연속 혈당 측정기입니다. 2014년 9월, 스탠퍼드 대학은 애플 HealthKit 및 Dexcom의 기기를 사용하여 제 1형 소아 당뇨병 환자의 혈당 관리에 대한 파일럿 테스트를 시행하겠다고 밝힌 바 있습니다.
하지만 문제는 센서로 측정한 혈당 데이터를 사용자의 스마트폰으로 바로 전송할 수 없었다는 점입니다. 데이터를 스마트폰에 전송하기 위해서는 ‘Share’ 라고 하는 별도의 발신용 전송 기기(docking cradle) 에 수신기를 꽂아야만 했습니다. 이렇게 별도로 전용 발신기가 필요했을 뿐만 아니라, 블루투스 방식으로 전송하기 때문에 스마트폰은 발신기와 15 피트 (약 4.5m) 거리에 있어야 했습니다. 더구나 이 발신기는 콘센트에 전원을 연결해야만 사용이 가능한 탓에 그마저도 이동시에는 사용하지 못했습니다. 이 ‘Share’ 발신기는 2014년 10월에 FDA 승인을 받은 바 있습니다.
이렇게, ‘측정한 데이터를 멀리 있는 스마트폰에 실시간으로 전송할 수 없다는 점’ 은 사용자들에게 큰 불편을 가져다 주었습니다. 특히, 연속 혈당 측정기의 대표적인 사용자인 소아당뇨병을 가진 어린 환자들과 그들의 부모들이 가지는 불편이 컸습니다. 왜냐하면 부모들이 직장에 있을 때, 자녀의 혈당 수치가 급변하는지를 원격으로 알 수 있는 방법이 없기 때문입니다. 또한, 자녀가 수면 중에 저혈당 쇼크에 빠지는지에 대해서도 항상 걱정해야만 했습니다.
하지만 이번 FDA의 의료기기 액세서리 가이드라인 개정에 의해서 dexcom은 고객들의 이러한 불편을 즉시 해결해줄 수 있게 되었습니다. 의료기기 본체와 액세서리의 리스크를 따로 판단하겠다는 방침에 의해, (데이터에 대한 별도의 분석이나 해석 없이) 단순히 데이터를 전송하고 디스플레이 하는 앱의 위험도는 크지 않다고 FDA가 판단한 것입니다. 그 결과 dexcom의 혈당 디스플레이 스마트폰 앱은 Class II 로 하향 조정되고, 시장 판매를 위해 별도의 사전 승인 절차 없이, 단순 등록만 필요하게 되었습니다. (의료기기 본체인 수신기는 원래대로 Class III 의 규제를 받게 됩니다)
이에 따라, 수신기를 Share 라는 전송장치에 부착할 필요 없이, 클라우드를 통해 언제 어디서나 스마트폰으로 바로 데이터를 전송할 수 있게 된 것입니다. 또한, 환자 본인의 스마트폰 뿐만 아니라, 최대 5명의 팔로워들에게도 데이터를 보낼 수 있게 되었습니다. 즉, 소아 당뇨병 환자의 경우, 부모나 학교 교사, 교내 간호사 등의 여러 보호자들이 언제 어디서나 스마트폰으로 환자의 혈당 수치를 실시간으로 확인할 수 있게 된 것입니다.
이러한 어플리케이션의 규제가 완화되었다는 것은 일견 간단해 보일 수도 있지만, 매우 중요한 변화입니다. 이는 FDA가 의료기기 액세서리에 관한 가이드라인을 발표한 직후에 나온 뉴스로, 모바일 헬스에 관한 규제를 대폭 완화하겠다는 FDA의 의지를 보여준다고도 할 수 있습니다.
또한, 아이러니하게도 비슷한 기능을 하는 경쟁사의 스마트폰 어플리케이션 역시, Dexcom의 선례 덕분에 FDA에 등록만 하면 서비스가 가능하게 되었습니다. 대표적으로, 2014년 9월 스마트폰 기반의 혈당 모니터링 시장에 진출을 선언한 Dexcom의 경쟁자 Medtronic 에게는 이번 소식이 호재로 작용할 것으로 예상됩니다.
Dexcom은 2014년 10월 Share 전송장치를 승인 받은지 불과 3개월여만에 사실상 이 중간 단계의 전송장치가 필요 없게 되었습니다. 때문에 회사는 기존의 Share 기기 사용자들에게 무료로 새로운 수신기로 업그레이드를 진행해주기로 하였습니다.
Dexcom의 혈당측정계, 애플 워치와 연동
더 나아가, FDA의 이러한 결정 덕분에 Dexcom은 2015년 4월로 예정된 애플 워치의 출시와 함께, 혈당 수치를 디스플레이하는 애플 워치 어플리케이션을 런칭하겠다고 발표하였습니다. 스마트폰에도 단순 디스플레이 앱은 Class II 등급으로 분류되어 사전 등록만 하면 되었듯이, 향후 스마트 워치에도 이러한 원칙은 동일하게 적용될 것으로 보이기 때문입니다.
사실 Dexcom은 FDA가 가이드라인을 새롭게 발표하기 이전부터 애플 워치 앱을 개발할 계획을 가지고 있었습니다. 이미 지난 CES 2015에서 Dexcom은 혈당 수치 디스플레이용 애플 워치 앱의 데모를 발표하기도 하였습니다. 이 앱의 인터페이스는 Dexcom 의 기존 기기에 디스플레이 되던 디자인과 유사합니다. 혈당 데이터는 애플의 HealthKit 플랫폼을 통해서 애플 워치로 전송될 것이며, 이 플랫폼에 연동된 다른 헬스케어 앱이나 기기도 이 혈당 데이터를 사용할 수 있게 될 가능성이 높을 것으로 점쳐지고 있습니다.
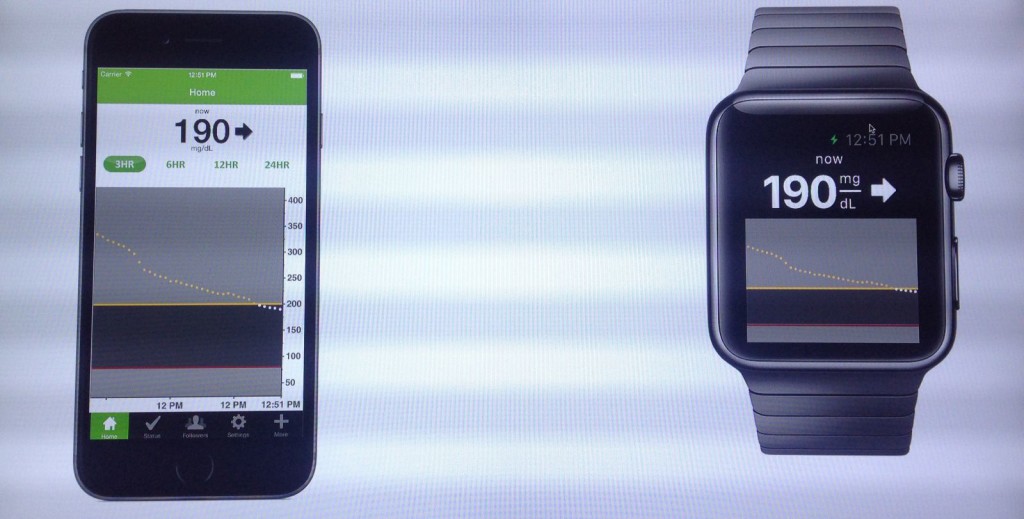
CES 2015에서 발표된 Dexcom의 스마트폰 앱과 애플 워치 앱 (출처: diaTribe)
애플이 개발하고 있다는 스마트 워치가 소위 ‘아이 워치’로 불리며 시장에서 루머로 떠돌 때, 가장 크게 기대 받았던 기능은 혈당 측정, 수면 모니터링 같은 고도의 헬스케어 측정이었습니다. 하지만 정작 애플 워치가 2014년 9월 대중에게 공개되었을 때, 단순한 활동량 측정에 그치는 기능만을 가지는 것이 드러나며 업계의 실망을 자아내었습니다. 고도의 헬스케어 센서가 포함되지 않은 이유로 FDA 규제 관련이나 혹은 배터리 성능 등이 점쳐지기도 하였습니다.
- 관련 포스팅: 애플 워치, 헬스케어 웨어러블의 게임 체인져가 될 것인가?
비록 애플 워치가 (아직까지는) 자체적인 센서로 혈당을 측정하지는 않지만, Dexcom이 혈당측정계를 애플 워치에 연동하게 됨으로써, 어찌되었건(?) 애플 워치는 혈당 수치 모니터링 기능을 가지게 되었습니다. 이는 많은 당뇨병 환자와 보호자들이 환영할 기능으로 보입니다.
오픈소스 DYI 프로젝트, FDA를 변화시키다
NightScout 에서 제작한 시스템 및 페블 워치를 통해서
부모들은 Dexcom 기기로 측정한 자녀의 혈당 수치를 실시간으로 확인할 수 있었다 (출처: WSJ)
FDA가 이토록 발빠르게 의료기기 액세서리에 관한 가이드라인을 발표하고 규제를 완화하기로 한 것에는 외부적인 요인도 큰 영향을 미쳤습니다. 바로 사용자들의 주도로 FDA의 규제를 우회하여 이미 실질적으로 이러한 기능을 구현한 시스템을 ‘민초’들이 구현하고 오픈소스를 통해 널리 전파하였기 때문입니다. 그 대표적인 사례가 바로 ‘우리는 무작정 기다리지 않겠다 (We are not waiting)’ 을 기치로 내걸고 있는 NightScout 프로젝트입니다.
Dexcom의 센서로 측정한 혈당 데이터를 사용자나 보호자의 스마트폰으로 바로 전송할 수 없었다는 점이 큰 문제였다는 것을 앞서 지적한 바 있습니다. 하지만 NightScout 프로젝트는 Dexcom이 혈당 수치를 스마트폰으로 바로 전송하기 위한 앱이 FDA 허가받기 이전부터, 동일한 기능을 하는 시스템을 자발적으로 구현하여 대중에게 무료로 배포하고 있었습니다. NightScout에서 개발한 소프트웨어를 탑재한 스마트폰을 Dexcom의 수신기(receiver)에 연결하여, 일반 사용자들도 혈당 데이터를 실시간으로 인터넷에 업로드할 수 있었던 것입니다.
업로드 된 혈당 데이터는 인터넷에 접속할 수만 있는 환경이라면 컴퓨터, 스마트폰, 타블렛 컴퓨터 등을 이용하여 언제 어디서든지 확인할 수 있었습니다. 심지어는 페블 스마트워치에서 이를 확인할 수 있게까지 해놓았습니다.
여기에 들어가는 모든 코드는 오픈 소스로 대중에게 공개되었으며, 이 시스템을 사용하기 위해서 별도의 금액을 지불할 필요는 없었습니다.
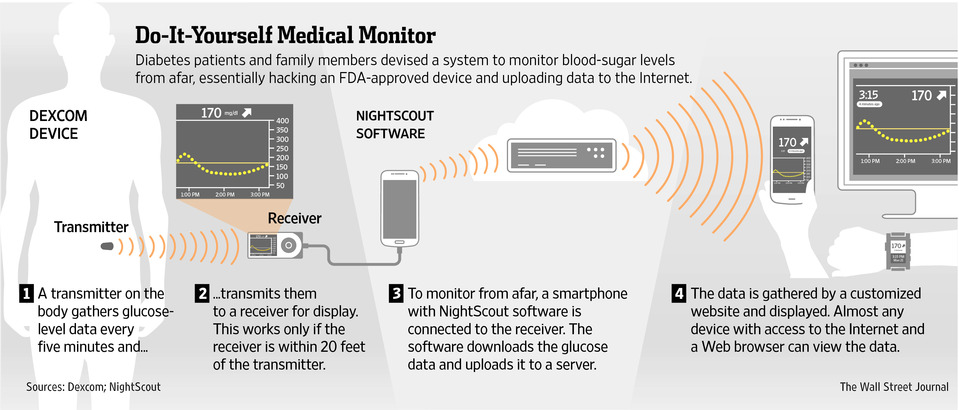 NightScout 시스템의 개요 (출처: WSJ)
NightScout 시스템의 개요 (출처: WSJ)
이 시스템을 만든 사람은 천재 해커들이 아니라, 주로 소아당뇨병에 걸린 자녀를 둔 평범한 소프트웨어 개발자들이었습니다. 기존의 Dexcom의 시스템으로는 직장에서 집에 있는 자녀들의 상태를 원격으로 모니터링 할 수 없었기 때문에 궁여지책으로 직접 이 시스템을 개발하기로 한 것입니다.
NightScout에서 개발한 시스템이 트위터와 페이스북 등에 공개되자 사람들의 반응은 매우 뜨거웠으며, 곧 수천 명의 사람들에게 퍼져나갔습니다. 이는 특정 회사가 아닌 많은 개인들이 자발적으로 제작하고, 온라인에 무료로 공개한 것이기 때문에 FDA로서도 이를 제재할 마땅한 근거가 없었습니다.
자발적으로 만들어진 이 DIY 시스템은 물론 완벽하지는 않았습니다. 수신기에 연결시키면 스마트폰의 배터리는 빨리 방전되었으며, 보안도 취약했습니다. 특히, 데이터를 업로드한 외부 서버가 정전 등으로 작동하지 않을 염려도 있었습니다. 실제로, 서버 중 몇개가 정전으로 다운되어서 몇 시간 동안 데이터의 송수신이 중단된 적도 있다고 합니다. NightScout의 페이지에도 이 프로젝트의 정확도 및 성능은 보장되지 않으며, 사용하는 사람 각자에게 책임이 있다는 경고가 언급되고 있습니다.
 (출처: NightScout)
(출처: NightScout)
하지만 이 NightScout 는 기존에 사용자들이 가졌던 큰 문제를 실제로 해결해주었습니다. 환자와 보호자들이 기존에는 가지지 못했던 당뇨병 관리에 대한 완전히 새로운 옵션을 제공해준 것입니다.
실제로 이 시스템을 활용하여 자녀의 목숨을 구했던 사레들이 종종 보고되기도 했습니다. WSJ에 따르면, 캘리포니아에 사는 간호사인 Kristin Andrews Derichsweiler 는 NightScout 덕분에 아들의 목숨을 구할 수 있었습니다. 그녀는 이 시스템을 통해 직장에서 집에 혼자 있는 아들의 혈당 수치가 낮게 떨어진 것을 알 수 있었다. 집에 전화를 해도 받지 않자, 급히 집으로 돌아온 그녀는 침대에 저혈당 상태로 쓰러져 있는 아들을 발견했다. 당시 아들의 혈당 수치는 23 mg/dL 으로 위험할 정도로 낮았고 (정상 수치는 80) 그녀는 아들에게 제 때 적절한 조치를 취할 수 있었습니다.
이렇게 FDA의 승인을 거치지 않고 원격으로 혈당 수치를 실시간 전송 및 디스플레이하는 시스템이 활발하게 퍼져 나가자 FDA도 급히 이에 대한 대책을 세울 수 밖에 없었을 것입니다. 환자와 환자의 가족들이 느리게 움직이는 규제 기관을 무작정 기다리지 않고, 자발적인 DIY 프로젝트로 시작하게 된 NightScout는 결국 FDA의 변화를 촉진시키는 계기가 되었습니다.
사회 전반에 걸쳐 풀뿌리 운동은 많은 변화를 만들어내고 있습니다. 이번 사례는 디지털 헬스케어 분야에서도 이러한 ‘민초’ 들의 움직임이 큰 변화를 만들어낼 수 있다는 것을 보여주고 있습니다. 기술의 발전만큼 규제가 뒤따르지 못하고, 여전히 불합리한 기준을 바꾸지 않고 있다면 이렇게 소비자 주도의 bottom-up 방식으로 규제를 두드리는 것이 결과적으로 큰 변화를 만들어낼 수도 있을 것입니다.
 (출처: NightScout)
(출처: NightScout)
- 대문 사진 이미지 출처: WSJ
Discover more from 최윤섭의 디지털 헬스케어
Subscribe to get the latest posts sent to your email.























[…] FDA, 모바일 헬스케어 규제 완화 (2) 오픈소스 프로젝트, FDA를 변화시키다 […]
[…] FDA, 모바일 헬스케어 규제 완화 (2) 오픈소스 프로젝트, FDA를 변화시키다 […]
[…] 기존에도 비슷한 원리로 혈당을 측정하는 기기가 있었습니다. 대표적으로 Dexcom의 G4 Platinum 연속 혈당계와 같은 기기입니다. 이는 복부에 역시 작은 패치를 부착하고 실형태의 […]
[…] FDA, 모바일 헬스케어 규제 개선 (2) 오픈소스 프로젝트, FDA를 변화시키다 […]
[…] FDA, 모바일 헬스케어 규제 개선 (2) 오픈소스 프로젝트, FDA를 변화시키다 […]
[…] 오픈소스 프로젝트, FDA를 변화시키다 […]