Genentech 에서 개발되고 있던 항암제 T-DM1이 지난 2월 22일 금요일에 HER2 양성 전이성 유방암 (HER2-positive metastatic breast cancer) 에 대해 드디어 FDA 승인을 받았습니다. Kadcyla 라는 상품명으로 며칠 내에 출시 될 이 약은 Antibody-drug Conjugate (ADC) 라는 형태로 시도되는 약 중 대표격으로 임상 시험을 거칠 때부터 벌써 많은 주목을 받고 있던 약입니다.
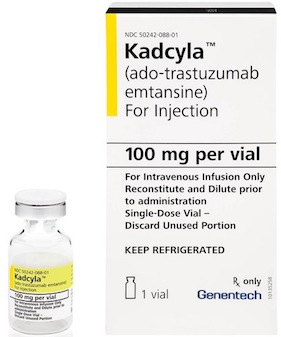
ADC 라는 것은 항암 표적을 특이적으로 인식할 수 있는 항체(antibody)에 독성을 지닌 물질 (toxin)을 달아서, “독성을 암세포에게만 특이적으로 전달하는” 것을 목표로 하고 있습니다. 항체는 표적을 특이적으로 인식하지만 약효가 제한적인 경우가 많고, 항암화학요법(chemotherapy)은 암세포를 보다 효과적으로 죽일 수는 있지만 독성이 암세포와 정상세포를 가리지 않고 무차별적(non-specific)으로 작용하기 때문에 부작용이 큽니다. 그래서 이 두 가지 형태의 약의 장점만을 살리고자 하는 것, 즉 항체로 암세포에 조준을 하면서 약효는 toxin을 통해서 나타나게 하는 일종의 “표적 항암화학요법 (targeted chemotherapy)” 을 실현시키고자 하는 것입니다.
T-DM1 이라는 이름에 그러한 항체와 독약(toxin)의 의미가 모두 포함되어 있습니다.
먼저, T 라는 것은 Trastuzumab 이라는 단일 클론 항체(monoclonal antibody) 의 첫글자를 따온 것입니다. 이 trastuzumab은 바로 그 유명한 ‘허셉틴(Herceptin)’ 입니다. 1998년 HER2 양성 전이성 유방암 (HER2-positive metastatic breast cancer) 에 대해 FDA 승인을 받은 이 허셉틴은 대표적인 항체치료제 중의 하나이자, (2012년 기준) 연간 $6 billion 이 넘는 매출을 올리고 있는 Genentech 의 수퍼 블록버스터 중의 하나입니다.
이 허셉틴은 HER2 (Human Epidermal Growth Factor Receptor 2, 또는, Neu, ErbB-2) 라고 하는 특정 유방암 세포의 표면에 많이 존재하는 표적 단백질을 특이적으로 인식하여 공격합니다. 전체 유방암 환자들 중, 암세포에 이 HER2가 많은 (=HER2 양성) 환자가 20-30% 라고 합니다. 즉, 허셉틴은 이 20-30%의 유방암 환자들에게 효과가 있는 약인 것입니다. HER2 라는 리셉터(receptor) 단백질은 세포 성장에 중요한 신호인 EGF 신호 전달 경로 (EGF signalling pathway) 에 핵심적인 역할을 합니다. 즉 이 HER2가 (정상세포에 비해) 암세포 표면에 엄청나게 많은 수가 존재함으로써, 암세포는 비정상적으로 빨리 자랄 수 있게 되는 것입니다.
허셉틴이 HER2 가 많은 암세포를 공격하는 작용 기전 (mode of action)은 아래 그림과 같이 여러 가지로 추측이 되고 있습니다 (이 원리에 대해 아직 정확하게 이해되고 있지 않은 부분도 많습니다). 허셉틴은 HER2 양성 암세포에 매우 효과적이지만, 일정 시간이 지나면 내성이 생기는 문제 또한 보고되고 있습니다.
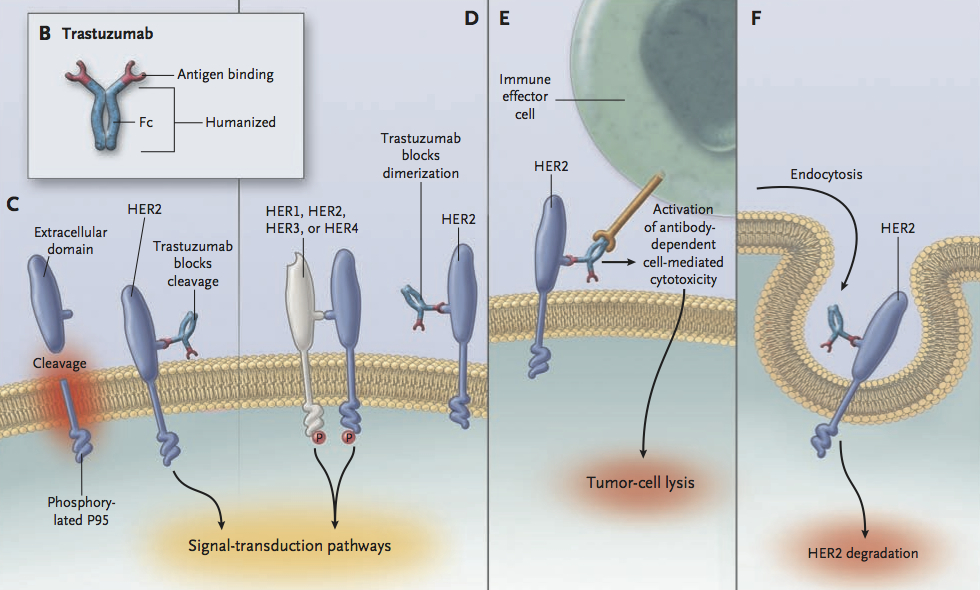 (출처: “Trastuzumab — Mechanism of Action and Use in Clinical Practice (NEJM)”
(출처: “Trastuzumab — Mechanism of Action and Use in Clinical Practice (NEJM)”
http://www.cellbiol.eu/docs/Herceptin%20review%20NEJM%20Hudis.pdf )
DM1은 이 허셉틴에 매단 일종의 독약(cytotoxic agent)의 이름입니다. DM1은 Maytansine 이라 불리는 종류의 독성 물질로 세포의 분열을 억제하는 물질이라고 보면 되겠습니다.
그럼 왜 하필이면 허셉틴에 이 DM1을 달았을까요? 위 그림의 가장 오른쪽 F 그림에서 볼 수 있듯이 허셉틴은 HER2 단백질에 결합한 후, HER2와 함께 세포 속으로 들어가는 (endocytosis) 매커니즘을 가지고 있습니다. 이렇게 세포 표면에 있는 HER2 의 수를 줄이기 때문에, 허셉틴만 쓰더라도 세포 밖에서 오는 신호를 좀 덜 받아들일 수 있게 되는 것입니다. 또한 이렇게 세포 속으로 들어가는 특징이 있기 때문에, 이 독성 물질을 허셉틴에 달아서 체내로 주입하면, 허셉틴이 HER2와 함께 암세포 안으로 들어갈 때 “독약도 함께 들어가게” 만들 수 있는 것입니다. (신기하게도 모든 항체가 이렇게 세포 속으로 들어가는 것은 또 아니라고 합니다.)
여기서 중요한 것은 이 독성 물질이 독성을 나타내는 “타이밍” 입니다. 독약을 항체에 매달아서 체내로 주입을 했을 때 너무 일찍 독성을 띄게 되면 몸 전체에 독성이 퍼질 것이고, 너무 늦게 작용하면 암세포를 죽일 수 없을 것입니다. 그래서 중요한 것이 이 독약 DM1과 허셉틴을 연결하는 링커(linker) 입니다. 고도의 기술로 매우 정교하게 설계된 링커 덕분에, 허셉틴이 암세포 안으로 들어간 후 적절한 타이밍에 이 독약이 비로소 독성을 띄게 되는 것입니다.
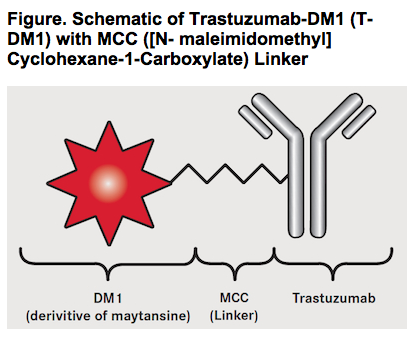 (T-DM1 의 개념도. (출처))
(T-DM1 의 개념도. (출처))
이 DM1 과 링커는 원래 ImmunoGen 이라는 회사에서 만들어진 독성 물질이며, ImmunoGen은 T-DM1의 매출에 대해서 로열티를 받게 됩니다. ImmunoGen은 지난 30년간 ADC 에 대해서 연구해왔는데, 이번 약이 회사에서는 FDA 승인을 받은 첫번째 약이라고 합니다. 이 DM1의 개발에는 2012년까지 ImmunoGen에 계시던 한인 재미과학자 Peter Park 박사님이 주도적인 역할을 하신 것으로 알려져 있습니다.
T-DM1 도 허셉틴과 같이 HER2 양성 전이성 유방암 (HER2-positive metastatic breast cancer)에 대해서 FDA 승인을 받았습니다. 기존 허셉틴+항암화학요법(chemotherapy)에 효과를 보지 못한 991명의 환자들이 참가한 임상실험에서, 전이성 유방암에 대한 기존의 약인 Tykerb와 Xeloda 를 병용 투여한 환자군에 비해서 T-DM1을 투여한 환자가 6.4 개월의 생명 연장 효과가 있었다고 합니다. 더욱이, 이렇게 더 좋은 약효와 함께, T-DM1은 상대적으로 더 적은 부작용을 보여주었습니다. Tykerb와 Xeloda 병용투여 대조군은 59%의 환자가 심각한 부작용을 보인 반면, T-DM1은 43% 였다고 합니다. (하지만 여전히 간, 심장에 대한 독성 및 사망에 대한 위험, 특히 임산부의 경우 태아에 대한 부작용이 경고 되고 있습니다) (임상에 대한 더욱 자세한 결과 및 데이터는 여기를 참고하시기 바랍니다)
이번 FDA의 T-DM1 에 대한 허가는 기존의 허셉틴과 taxane에 대해서 약효가 없었던 환자들을 대상으로만 사용할 수 있도록 한 것입니다. 하지만 제넨텍/로슈는 전이성 유방암에 대한 초기투여(initial treatment)에 대해서도 임상을 진행중이며, 지난 6월에 허가를 받은 HER2 양성 유방암에 대한 제넨텍의 또 다른 단일 클론 항체 신약인 Perjeta (Pertuzumab) 와의 병용 투여에 대한 임상도 진행중이라고 합니다.
제조사인 Genentech은 이 약의 가격은 한달에 $9,800, 혹은 한번의 9.5개월이 걸리는 전체 치료 코스에 $94,000 으로 책정될 것이라고 밝혔습니다. 허셉틴에 비하면 거의 두 배에 가까운 약가입니다만, 최근 새롭게 출시되고 있는 항암제들과 비슷한 약가라고 합니다. 또한, 이 약의 매출은 $2 billion 에서 $5 billion 정도로 예측되고 있습니다.
허셉틴과 제조사 및 적응증도 같지만 효과는 더 좋기 때문에, 기존 허셉틴의 매출을 상당 부분 잠식하지 않을까 하는 예상도 나오고 있습니다. 하지만 허셉틴의 특허 (미국) 가 2019년에 만료된 후 값싼 바이오시밀러들의 경쟁에 직면할 것이기 때문에, 제넨텍/로슈의 입장에서는 이러한 허셉틴의 시장을 이어받을 수 있는 T-DM1의 허가가 반가울 수 밖에 없을 것입니다. 또한 허셉틴이 Metastatic Gastric Cancer 등 몇개의 적응증에 허가를 더 받았듯이, T-DM1의 적응증 역시 점차 확대되리라 봅니다.
Discover more from 최윤섭의 디지털 헬스케어
Subscribe to get the latest posts sent to your email.


![[칼럼] 1000 달러 게놈 시대의 암 맞춤 치료 (1)](https://www.yoonsupchoi.com/wp-content/uploads/2014/03/web-genome-meulian-copy-140x90.jpg)